Protein Yapısı
Artan biçimde, ilaç geliştiricileri büyük molekülleri ve özellikle proteinleri terapötik bir seçenek olarak araştırmaktadır. Bir protein ilaç ürününün formülasyonu oldukça zor olabilir, ancak protein yapısının doğasını ve formüle edilen spesifik proteinin konformasyon özelliklerini iyi bilmeden, sonuçlar yıkıcı olabilir. Bu teknik özet, okuyucuya protein yapısını hızlı bir şekilde gözden geçirmeyi amaçlamaktadır. Ayrıca, protein yapısının formülasyon sırasında nasıl etkilenebileceğini ve hem yapıyı belirlemek hem de proteinin kararlılığını analiz etmek için kullanılabilecek bazı analitik yöntemleri kısaca ele alacaktır .
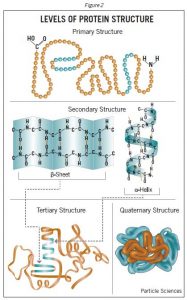
Proteinler ile ilişkili olarak kullanılan terim yapısı , küçük moleküller için olduğundan çok daha karmaşık bir anlam kazanır. Proteinler makromoleküllerdir ve dört farklı yapı seviyesine sahiptir – birincil, ikincil, üçüncül ve dörtlüdür.
Birincil Yapısı
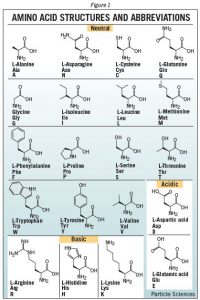
Protein yapımı için hücreler tarafından kullanılan 20 farklı standart L-a-amino asit vardır. Adlarının belirttiği gibi amino asitler hem bir bazik amino grubu hem de bir asidik karboksil grubu içerir. Bu difonensellik, tek tek amino asitlerin, peptid bağları oluşturarak uzun zincirlerde bir araya gelmelerine izin verir : bir amino asidin -NH2’si ile bir diğerinin -COOH’si arasında amid bağlarıdır. 50’den az amino asitli diziler genellikle peptitler olarak adlandırılırken , protein veya polipeptit terimleri daha uzun diziler için kullanılır.
Bir protein bir veya daha fazla polipeptid molekülünden oluşabilir. Peptit veya protein dizisinin bir serbest karboksil grubu ile sona ermesi karboksi-terminus veya C-terminus olarak adlandırılır. Amino-terminus veya N-terminus terimleri , dizinin ucunu serbest bir a-amino grubu ile tarif eder.Amino asitler, yan zincirlerindeki ikame edici tarafından yapı bakımından farklıdır. Bu yan zincirler, nihai peptid veya proteine farklı kimyasal, fiziksel ve yapısal özellikler kazandırır. Proteinlerde yaygın olarak bulunan 20 amino asidin yapıları Şekil 1’de gösterilmektedir. Her amino asidin hem tek harfli hem de üç harfli bir kısaltması vardır.
Bu kısaltmalar, bir peptit veya proteinin yazılı dizisini basitleştirmek için yaygın olarak kullanılır.
Yan zincir ikamesine bağlı olarak, bir amino asit asidik, bazik veya nötr olarak sınıflandırılabilir. İnsanlarda bulunan çeşitli proteinlerin sentezi için 20 amino aside ihtiyaç duyulmasına rağmen, sadece 10 sentez yapabiliriz. Geriye kalan 10’a esansiyelamino asit denir ve diyette elde edilmesi gerekir.
Bir proteinin amino asit dizisi DNA’da kodlanır. Proteinler transkripsiyon adı verilen bir dizi adım ile sentezlenirler (bir DNA zincirinin bir serbest mesajcı RNA dizisi – mRNA yapmak için kullanımı) ve dönüşümü mRNA dizisi, amino asitler zincirinin sentezini yönlendiren bir şablon olarak kullanılır. Sıklıkla, proteinin biyolojik işlevi için gerekli olan glikozilasyon veya fosforilasyon gibi post-translasyonal modifikasyonlar meydana gelir. Amino asit dizisi proteinin birincil yapısını oluştururken, proteinin kimyasal / biyolojik özellikleri üç boyutlu veya üçüncül yapıya çok bağlıdır.
İkincil Yapısı
Proteinlerin veya peptitlerin esnetilmeleri veya şeritleri , hidrojen bağlamasına bağlı olarak, belirgin karakteristik lokal yapısal uyumlara veya ikincil yapıya sahiptir . İki ana ikincil yapı türü a-sarmal ve ß-levhadır.
Α-sarmal bir sağ elini sarmal telidir. Bir a-sarmalındaki amino asit gruplarının yan zincir ikameleri, dışarıya doğru uzanır. Hidrojen bağları, iplikteki her bir peptit bağının C = O’sinin oksijeni ile peptitin NH grubunun hidrojeni, sarmalın altındaki dört amino asidi bağlar. Hidrojen bağları bu yapıyı özellikle kararlı hale getirir. Amino asitlerin yan zincir ikameleri, NH gruplarının yanında yer alır.
Tersiyer Yapısı
Tüm bir protein molekülünün genel üç boyutlu şekli, tersiyer yapıdadır . Protein molekülü, maksimum stabilite veya en düşük enerji durumuna ulaşacak şekilde bükülecek ve bükülecektir. Bir proteinin üç boyutlu şekli düzensiz ve rastlantısal görünebilir olsa da, amino asitlerin yan zincir grupları arasındaki bağlanma etkileşimleri nedeniyle pek çok dengeleyici kuvvet tarafından modellenir.
Fizyolojik koşullar altında, fenilalanin veya izolösin gibi nötr, polar olmayan amino asitlerin hidrofobik yan zincirleri, protein molekülünün iç kısmına gömülme eğilimindedir, böylece bunları sulu ortamdan korurlar. Alanin, valin, lösin ve izolösin alkil grupları, sıklıkla birbirleri arasında hidrofobik etkileşimler oluştururken, fenilalanin ve tripozin gibi aromatik gruplar sıklıkla birlikte toplanır. Asidik veya bazik amino asit yan zincirleri genellikle hidrofilik oldukları için proteinin yüzeyine maruz bırakılacaktır.
Sülfidril gruplarının sistein üzerinde oksidasyon uyladisülfür köprülerin oluşumu, protein üçüncül yapısının stabilizasyonunun önemli bir yönüdür ve protein zincirinin farklı bölümlerinin kovalent olarak bir arada tutulmasına izin verir. Ek olarak, farklı yan zincir grupları arasında hidrojen bağları oluşabilir. Gibi disülfidköprüleri , bu hidrojen bağları sekansının özelliği açısından bazı mesafe uzaklıktadır bir zincir, iki parça bir araya getirebilir. Tuz köprüleri , amino asit yan zincirleri üzerinde pozitif ve negatif yüklü bölgeler arasındaki iyonik etkileşimler, aynı zamanda bir proteinin tersiyer yapısının stabilize edilmesine yardımcı olur.
Kuaterner Yapısı
Çoğu protein, genellikle protein alt birimleri olarak adlandırılan çoklu polipeptit zincirlerinden oluşur . Bu alt birimler, aynı (bir homodimerde olduğu gibi) veya farklı olabilir (bir heterodimerde olduğu gibi). Kuaterneryapı , bu protein alt-birimleri birbirleri ile etkileşim ve daha geniş bir agrega protein kompleksi oluşturmak üzere olan etkileşimlerine işaret eder. Protein kompleksinin son şekli, hidrojen bağlama, disülfür köprüler ve tuz köprüler dahil olmak üzere çeşitli etkileşimlerle bir kez daha dengelenir. Dört protein yapısı seviyesi Şekil 2’de gösterilmiştir.
Protein Kararlılığı
Üç boyutlu yapıyı kontrol eden zayıf etkileşimlerin doğası gereği, proteinler çok hassas moleküllerdir. Doğal durum terimi, proteini asıl olduğu yerde en kararlı doğal konformasyonunda tanımlamak için kullanılır. Bu doğal durum, sıcaklık, pH, suyun uzaklaştırılması, hidrofobik yüzeylerin varlığı, metal iyonlarının varlığı ve yüksek kesme gibi bir dizi dış stres faktörü tarafından bozulabilir. Bir stres faktörüne maruz kalmadan dolayı ikinci, tersiyer veya kuaterner yapı kaybı denatürasyon olarak adlandırılır.
Denatürasyon, proteinin gelişigüzel veya yanlış katlanmış bir şekle girmesine neden olur.
Denatüre edilmiş bir protein, doğal formundaki proteinden, genellikle biyolojik fonksiyonu kaybederek, oldukça farklı bir aktivite profiline sahip olabilir. Denatüre olmanın yanı sıra, proteinler de belirli stres koşulları altında agregalar oluşturabilirler. Agregalar genellikle imalat prosesi sırasında üretilir ve genellikle tatbik edilmediğinde, istenmeyen bağışıklık tepkilerine neden olma ihtimalinden dolayı genellikle istenmeyen bir durumdur.
Bu fiziksel protein bozunma biçimlerine ek olarak, protein kimyasal bozunmasının muhtemel yollarının farkında olmak da önemlidir. Bunlar arasında oksidasyon, deamidasyon, peptit-bağ hidrolizi, disülfit-bağ yeniden karıştırılması ve çapraz bağlanma bulunur. Herhangi bir liyofilizasyon aşaması da dahil olmak üzere proteinlerin işlenmesi ve formülasyonunda kullanılan yöntemler, bozulmayı önlemek ve protein biyofarmasötikinin hem depoda hem de ilaç verme sırasında stabilitesini arttırmak için dikkatle incelenmelidir.
Protein Yapısı Analizi
Protein yapısının karmaşıklıkları, en gelişmiş analitik ekipmanla bile tam bir protein yapısının açığa çıkarılmasını son derece zorlaştırır. Hangi amino asitlerin mevcut olduğunu ve her birinin molar oranlarını belirlemek için bir amino asit analizcisi kullanılabilir. Protein dizisi daha sonra peptit haritalaması ve Edmandegradasyonu veya kütle spektroskopisi kullanılarak analiz edilebilir. Bu süreç, peptidler ve küçük proteinler için rutindir, ancak büyük multimerik proteinler için daha karmaşık hale gelir.
Peptit haritalaması genellikle, dizinin spesifik yarılma bölgelerinde daha küçük peptitlere ayrılması için farklı proteaz enzimleri ile proteinin tedavisini gerektirir. Yaygın olarak kullanılan iki enzim, tripsin ve kimotripsin’dir. Kütle spektroskopisi, enzim sindirilmiş proteinlerin analizi için, peptit parmak izi yöntemleri ve veri tabanı araştırması ile paha biçilemez bir araç haline gelmiştir. Edmandegradasyonu, N-terminalinden başlayarak, kısa bir peptitten bir kerede bir amino asidin bölünmesini, ayrılmasını ve tanımlanmasını içerir.
Bir proteinin ikincil yapısını tanımlamak için kullanılan bir yöntem, dairesel dikroizm spektroskopisidir (CD). Farklı ikincil yapı tipleri, a-sarmal, ß-levha ve rastgele bobinlerin tümü, spektrumun uzak-uv bölgesinde (190-250 nm) karakteristik dairesel dikroizm spektrumlarına sahiptir. Bu spektrumlar, her bir yapı tipinden oluşan tüm proteinin kesirine yaklaşmak için kullanılabilir.
Bir proteinin üç boyutlu yapısının daha eksiksiz, yüksek çözünürlüklü bir analizi, X-ışını kristalografisi veya nükleer manyetik rezonans (NMR) analizi kullanılarak gerçekleştirilir. Bir proteinin X-ışını kırınımı ile üç boyutlu yapısını belirlemek için büyük, iyi düzenlenmiş tek bir kristal gereklidir. X-ışını kırınımı, atomlar arasındaki kısa mesafelerin ölçülmesine izin verir ve protein yapısının bir modelini oluşturmak için kullanılabilecek üç boyutlu bir elektron yoğunluk haritası verir.
Bir proteinin üç boyutlu yapısını belirlemek için NMR’nin kullanılması, X-ışını kırınımı üzerinde, çözeltide gerçekleştirilebilmesi için bazı avantajlara sahiptir ve bu nedenle protein, kristal kafesinin kısıtlamalarından muaftır. Genelde kullanılan iki boyutlu NMR teknikleri, boşluklar arasındaki atomlar arasındaki mesafeleri ve bağlar yoluyla mesafeleri ölçen COESY’yi ölçen NOESY’dir.
Protein Yapısı Kararlılık Analizi
Bir proteinin stabilitesini belirlemek için birçok farklı teknik kullanılabilir. Bir proteinin açılım analizi için, floresan, UV, kızılötesi ve CD gibi spektroskopik yöntemler kullanılabilir. Diferansiyel taramalı kalorimetri (DSC) gibi termodinamik yöntemler, sıcaklığın protein stabilitesi üzerindeki etkisini belirlemede yararlı olabilir. Karşılaştırmalı peptit haritalama (genellikle LC / MS kullanılarak), oksidasyon veya deamidasyon gibi bir proteindeki kimyasal değişikliklerin belirlenmesinde son derece değerli bir araçtır. HPLC ayrıca bir proteinin saflığını analiz etmenin paha biçilemez bir yoludur. SDS-PAGE, iso-elektrik odaklama ve kapilerelektroforez gibi diğer analitik yöntemler de protein stabilitesini belirlemek için kullanılabilir ve bir protein biyofarmasötiğinin gücünü belirlemek için uygun bir biyo-analiz kullanılmalıdır.
Protein stabilitesini belirlemek için kullanılan yöntemlerin çeşitliliği, protein yapısının doğasının karmaşıklığını ve başarılı bir biyofarmasötik ürün için bu yapıyı korumanın önemini vurgulamaktadır.
Referanslar
- Protein Yapısı, Stabilite ve Katlama, Moleküler Biyolojide Yöntemler, Cilt. 168, Kenneth P. Murphy tarafından düzenlendi
- Protein Stabilitesi ve Katlama, Teori ve Uygulama, Moleküler Biyolojide Yöntemler, Cilt. 40, Bret A. Shirley tarafından düzenlendi