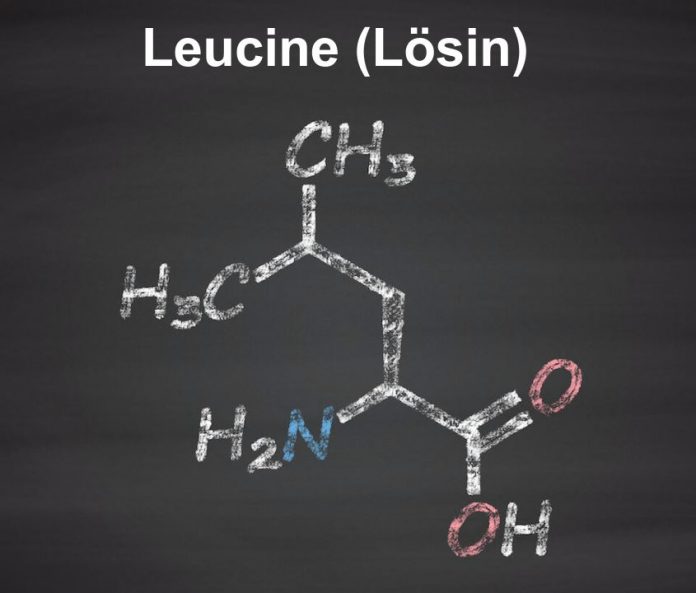
Leucine (Lösin) Nedir Ve Ne İşe Yarar ?
Leucine (Lösin), birincil BCAA‘dır ve en çok fayda sağlayan BCAA’dır. Leucine (Lösin’in) kendi başına kullanılması hala faydalıdır ve BCAA karışımlarından daha ucuz olabilir; Ancak yine de hepsi acı tadı vardır.
Özet
Tüm Temel Faydalar / Etkiler / Gerçekler ve Bilgiler
Leucine (Lösin), üç dallı zincirli amino asidinden biridir ve bazen Leucine (Lösin) kaynaklı BCAA’nın en popüler yararı nedeniyle’ ana ‘amino asit olarak anılır. Leucine (Lösin), daha sonra S6K yoluyla kas protein sentezini uyaran mTOR olarak bilinen proteinin bir aktivatörüdür; diğer iki BCAA da mTOR’u aktive edebilir, ancak bunu yaparken Leucine (Lösin)’den çok daha zayıftır (ve böylece 5 g Leucine (Lösin), 5 g karışık BCAA’lardan daha etkilidir). Leucine (Lösin) metaboliti, HMB , yağsız kütlenin parçalanmasından daha etkili olmasına rağmen kas protein sentezini uyarmada da Leucine (Lösin)’den zayıftır.
Leucine (Lösin), diğer iki BCAA izolösin ve valinden biraz farklıdır, çünkü diğer iki BCAA de çalışılmadığı halde, Leucine (Lösin), bir BCAA karışımı yerine, izolasyonlu amino asit üzerinde test edilecek gibi görünüyor.
Leucine (Lösin) değerlendiren çalışmalar çoğunlukla supplement Leucine (Lösin) diyet veya test yemeğine eklendiğinde kas protein sentezine bakar ve test yemeklerinden sonra Leucine (Lösin’in) kas protein sentezini güvenilir şekilde artırabileceği görülür. Bunun bir süre içinde daha yağsız bir kütle ile sonuçlanıp sonuçlanmadığı, daha az güvenilir olsa da, Leucine (Lösin), daha düşük diyet protein alımı olan kişilerde ve kas protein sentezinde bozulmaya eğilimli olan yaşlılarda kas kazanımlarını arttırmada daha etkili gibi görünmektedir.
Dürüst olmak gerekirse, Leucine (Lösin) ile glikoz arasındaki etkileşimler net değildir. Leucine (Lösin) hem kan şekeri azaltıcı özelliklere sahiptir (insülin pankreasından salabilir, doğrudan insülinsiz bir hücre içine glikoz alımı uyarabilir) hem de tam tersi (insülin tarafından uyarılan glikoz alımını engelleyebilen S6K uyararak).
Bir hücre kültüründe Leucine (Lösin), 45 dakikaya kadar glikoz alımını uyarır ve sonra canlı sistemlerdeki kısa süreli Leucine (Lösin) dozları dikkate değer bir şey yapmadığı halde (Leucine (Lösin) diyabette rehabilite edilebileceğine dair bazı sınırlı kanıtlar, ancak bu ön örnektir) . İzolösin daha güçlü bir kan şekeri düşürücü bir maddedir, ancak kendi hareketlerinin daha az bastırmasıdır.
Bilmen Gerekenler
Ayrıca şöyle bilinir
L-Leucine (Lösin)
Şaşırmayın
BCAA , Leucic asit (bir metabolit)
Dikkat Edilmesi Gerekenler
- Leucine (Lösin) uyarıcı değil
- Leucine (Lösin) toz olarak acı bir tada sahiptir; bu da sıcaklığı düşürerek veya ekşi tat verici madde ilave ederek hafifletebilir
Leucine (Lösin) Bir Formudur
- Kas Oluşturucu
- Amino Asit Desteği
Aşağıdakiler İçin Kullanılır
- Kas Kazancı ve Egzersiz
- Genel Sağlık
Leucine (Lösin) İle İyi Gidiyor
Resveratrol (mitokondriyal biyogenez için)
Leucine (Lösin) İle İyi gitmiyor
Aromatik amino asitler (Triptofan ve L-Tyrosine )
Leucine (Lösin) Tarihi
Leucine (Lösin), 1819 yılında peynirde saf haliyle keşfedilen bir amino asittir. Bu amino asit, adını “beyaz” anlamına gelen Yunanca kelime lökosundan almıştır, çünkü o zaman söz konusu maddenin doğaldan beyaz kristalize bir duruma arındırılması dikkate değer bulunmuştur. Sadece 19. yüzyılın sonunda Leucine (Lösin) yapısı laboratuvar sentezi ile kurulmuştur. Bu amino asit ayrıca üç dallı zincirli amino asitten (BCAA) biri olarak tanınır.
Leucine (Lösin) Nasıl Kullanılır Ve Kullanımı Nedir ?
Leucine (Lösin) , kısa süreli kullanım için 2.000-5.000 mg aralığında kullanımı vardır ve böylece kullanılır. Açlık durumunda veya içeriğinde düşük miktarda protein içeriği olan (veya Leucine (Lösin) seviyesinde düşük protein kaynakları olan) yemeklerle birlikte kullanılma eğilimindedir.
1 Kaynaklar ve Yapı
1.1. Kaynaklar
Leucine (Lösin) (2-Amino-4-metilpentanoik asit olarak da bilinir), dallı zincirli amino asit sınıfının (izolösin ve valinin yanında) gerekli bir amino asittir. Üç amino asitten Leucine (Lösin), mTOR olarak bilinen (kas proteini sentezini olumlu şekilde etkileyebilen) bir proteinin en güçlü aktivatörü olarak göze çarpmaktadır ve ayrıca sadece ketojenik bir amino asittir [1] [2] (keton üreten).Vücut katabolizma sonrası, valin glikojeniktir (üretilen glikoz) ve izolösin her ikisidir.
Leucine (Lösin), bazen ana BCAA olarak anılan dallı zincirli amino asitlerden biridir. Kas protein sentezinin moleküler düzeyde en güçlü uyarıcısıdır ve ketojeniktir (metabolize olduğunda üretilen ketonlar).
1.2 Metabolizması
Leucine (Lösin), vücutta dallı zincirli aminotransferaz enzimi (BCAT) tarafından α-Ketoizokaproik asit (KIC) olarak bilinen ara maddeye tersine çevrilerek olarak metabolize olur. KIC, β-hidroksiizovalerat (mitokondriyal KIC dioksigenaz enzim yoluyla yoluyla ),[3] izovaleril-CoA’ya ( dallı zincirli α-keto asit dehidrojenaz (BCKDH) aracılığıyla) [4] veya HMB’ye sitosolik KIC dioksigenaz enzim yoluyla); HMB’ye son metabolizma yolu, yutulan lösinin yaklaşık% 5’i ve vücuttaki tek HMB kaynağıdır. [5]
- BCAT :En suda çözünmez olan dallı zincirli amino asitlerinden (BCAA) üçü, lösin, izolösin ve valini a-amino gruplarının transferini tersine katalize eder.
- KIC : Leucine (Lösin) için metabolik yoldaki metabolik ara maddelerdir.
- İzovaleril-CoA :Dallı zincirli amino asitlerin metabolizmasında bir ara üründür.
Α-Ketoizokaproik asiti (KIC) β-hidroksiizovalerata dönüştüren ilk yol da KIC’yi α-hidroksikaproik asit (Leucic asit veya HICA) olarak bilinen metabolit haline dönüştürebilir.
Leucine (Lösin), çeşitli metabolitlerden birine metabolize edilir ve bu da Leucine (Lösin) etkilerine katkıda bulunabilir. Bunlardan ikisi bağımsız takviyedir (HMB ve HICA).
2 Farmakoloji
2.1 Hareket Mekanizması
Leucine (Lösin)’in birincil etki mekanizması, memelilerde mTOR olarak adlandırılan Rapamisidin Hedefinin (TOR) aktivasyonudur (özellikle, Leucine (Lösin), kompleksin iki alt grubundan biridir, [6] mTORc1’i aktive eder.
- Prolin :Proteinlerin biyosentezinde kullanılan proteinogenik bir amino asittir.
- PKB / Akt / PI3K / Rheb / mTOR :Kas protein sentezini tetiklemek üzere aktive olan proteinler
İlk kompleks (mTORc1), birkaç proteinin bir kompleksidir; TOR’un kendisi, TOR (Raptor), G-protien β-alt birim benzeri protein (GβL) ve prolin açısından zengin PKB / Akt substratı olan 40kDa’nın (PRAS40) düzenleyici ilişkili proteinin yanındadır. [7] [8] Bu kompleks, Leucine (Lösin) takviyesi ile aktive edilirken, diğer kompleks (Rector ve Proctor olarak bilinen kendi düzenleyici proteini olarak bilinen TOR’un başka bir düzenleyici proteinini, yine GβL ve bir protein mSin1 olarak bilinir) Leucine (Lösin) tarafından aktifleştirilmez.
TOR veya memeli TOR (mTOR), hücresel sinyallemenin düzenlenmesinde önemli bir rol oynayan bir protein kompleksidir. Leucine (Lösin), oluşturduğu iki kompleksin birisini, mTORc1 olarak (c1, ‘kompleks’ olarak adlandırılır) aktive edebilir. Bu makalede mTOR’dan bahsedildiğinde, aksi belirtilmediği sürece mTORc1 için kısaltmadır.
İnsülin reseptörü üzerinden yapılan sinyalizasyon, mTOR’u (Sınıf 1 PI3K ve Akt / PKB, Rheb ve mTOR [8] aktifleştirerek) uyarabilirken, Leucine (Lösin)’den mTOR resmen insan vakuoler protein sıralama 34 (hVPS34) olarak bilinen bir proteine benziyor [9] ancak bazen de PI3K sınıfı 3 olarak bilinir. [10]
hVPS34 tükenmesinin, insülin kaynaklı Akt aktivasyonunu engellemediği halde Leucine (Lösin) kaynaklı mTOR aktivasyonunu küntleştirdiği bilinmektedir. [9] Bir hücrenin Leucine (Lösin) ile kuluçkalanması Akt’i aktive etmeden mTOR’u aktive eder. [11] [12] Bu etki, hücre içi kalsiyumun genel bir artışına çok benzer; [13] [14 ] ilginç olarak, Leucine (Lösin), hücre içi kalsiyumun artmasıylamTOR aktivitesini uyardığı düşünülmektedir, çünkü kalsiyumdaki artış ve kalp modülünün (kalsiyum homeostazı ile ilgili bir protein) hVPS34’e bağlanması, Leucine (Lösin) kaynaklı mTOR aktivasyonu için hayati önem taşımaktadır. [15] [16]
- SHP-2 :Hücre büyümesi, farklılaşması, mitotik döngüsü ve onkojenik transformasyon dahil olmak üzere çeşitli hücresel süreçleri düzenleyen sinyal molekülleri olduğu bilinmektedir.
- S6K1 : Hücre büyümesi ve G1 hücre döngüsü ilerlemesi için gerekli olan RSK ailesinin bir AGC kinazıdır. Fosfoinositid 3 kinazın (PI3K) akış aşağısında, mitojenik yollarda mTOR ile fosforillenir ve aktive edilir.
Kas protein sentezinde kritik olan SHP-2 (bir tirosin fosfataz) olarak bilinen ve besin yoksunluğu dönemlerinde kas gelişimini sınırlayan [18] bir protein vardır ve hücre içi mobilizasyonu yoluyla S6K1’e sinyal gönderdiği görülmektedir. [18] Kalsiyumun fosfolipaz Cβ4’ün yukarı akış yönünde bir noktada bulunması ve mTOR’un Rheb protein uyarımı yoluyla işe yaradığı görülmektedir. [16] Rheb proteinlerinin doğal olarak mTOR fonksiyonunun pozitif düzenleyicisi olduğu bilinmektedir. [19]
Leucine (Lösin) ve / veya metabolitleri, kas kasılmasına benzer şekilde hücre içi kalsiyumu arttırdığı ve kalsiyumun artışı, kas proteini sentezini başlatan mTOR gibi proteinleri aktive edecektir. Bununla birlikte, kas kasılmasının aksine, Leucine (Lösin) muhtemelen bunu iskelet kasına yerelleşmekten çok tüm hücrelerde yapar.
Başka bir deyişle: SHP-2 (şu anda zincirin en uzağında) -> kalsiyum mobilizasyonu -> kalpodülin için hVPS34 bağlanması -> mTORc1 aktivasyonu (muhtemelen Rheb aracılığıyla) -> S6K1 aktivasyonu -> kas proteini sentezidir.
2.2 Hiper-Aminoasidemi
Hiper (aminoasit) emia, kandaki (-emia) aşırı miktardaki (hiper-) amino asitleri ifade etmek için kullanılan bir terimdir ve buna benzer şekilde, hiper-ürezinemi, özellikle çok fazla Leucine (Lösin) anlamına gelir.
Yaşlı erkeklerde, Leucine (Lösin)’in, kas protein sentezini bağımsız bir ön belirleyicidir, hiper-aminoasidemiden bağımsız olarak kas protein sentezini arttırdığı tespit edilmiştir. [20]
3 Ömür Uzatma
3.1 Sirtuin
Sirtuin proteinleri (SIRT), hücrenin NAD + / NADH oranına ve böylelikle bir hücrenin enerji durumuna duyarlı NAD + bağımlı enzimlerdir. [21] SIRT1 nükleer protein p53, NF-κB ve FOXO’nun sinyalizasyonunu değiştirebilen ve mitokondriyal biyogenez faktörü PGC-1α’yı uyarabilen bir histone deasetilazdır. [24] SIRT1’in aktivasyonu (bunu en sık rastlanan molekül resveratrol ) uzun ömürlü bir mekanizma olarak düşünülür.
- SIRT :NAD-bağımlı deasetilaz sirtuin-1 olarak da bilinen Sirtuin 1, insanlarda SIRT1 geni tarafından kodlanan bir proteindir.
- NAD + / NADH :NAD + oksitleyici bir maddedir – diğer moleküllerden elektronları kabul eder ve azalır. Bu reaksiyon, daha sonra elektronları bağışlamak için bir indirgeyici ajan olarak kullanılabilen NADH’ı oluşturur. Bu elektron transfer reaksiyonları NAD’nin ana işlevidir.
- Mitokondriyal biyogenez :Hücrelerin mitokondriyal kütleyi arttırdığı süreçtir. İlk olarak 1960’larda John Holloszy tarafından tanımlandı.
- PGC-1α:Hücrelerde hücresel biyojenezin merkezi bir uyarıcısı olan bir transkripsiyonel koaktivatördür.
- p53 : Hücre döngüsünü düzenleyen ve dolayısıyla bir tümör bastırma işlevi gören bir proteini kodlayan bir gendir.
- NF-κB :DNA’dan RNA’ya genetik bilginin aktarımını, sitokin üretimini ve hücre sağkalımını kontrol eden bir protein kompleksidir.
- FOXO :FOXO proteinleri, Transkripsiyon faktörlerinin Forkhead ailesinin bir alt grubudur. Bu aile korunmuş DNA bağlayıcı bir alan ile karakterizedir.
Lösinin, sağlığın desteklenmesi ve farelerde erken ölüm riskinin azaltılması için bağımsız olarak gösterilen süt ürünü proteinlerinin sağlık faydalarının temelini oluşturduğu düşünülmektedir. [25] [26] [27] Sütten zengin bir diyet tüketen hastalardan alınan kan, laboratuvar ortamında SIRT1 aktivitesini% 13 (iç yağı ) ve% 43 (kas dokusu) oranında uyarmak için gösterilmiştir; bu da biyolojik mantığı düşündürmektedir. [25]
Her iki Leucine (Lösin) metaboliti (α-Ketoizokaproik asit ve HMB )% 30-100 aralığında SIRT1’in aktivatörleri olup, resveratrol (2-10μM) ile karşılaştırılabilir; bir potens olup daha yüksek bir konsantrasyona (0.5mM) ihtiyaç duyar. [25] Mitokondriyal biyogenez, hem yağ hem de kas hücrelerinde Leucine (Lösin) kuluçkalanması kaydedildi ve SIRT1’in yok edilmesi, Leucine (Lösin) ile uyarılan mitokondriyal biyogenezi zayıflattı (ancak yok etmedi). [28]
Leucine (Lösin) metabolitleri, mitokondriyal biyojenezin altında yattığı düşünülen bir mekanizma olan SIRT1 aktivitesini uyarabilir. Bunu yaparken aslında orta derecede güçlüdür.
4 Glukoz Metabolizması ile Etkileşimleri
4.1 Glikoz Alımı
Leucine (Lösin) insülin kaynaklı Akt aktivasyonunu destekleme potansiyeline sahiptir, ancak ilk önce PI3K’nın bastırabilmesini veya bastırılmasını gerektirir (ve daha sonra Leucine (Lösin) insülin kaynaklı Akt aktivasyonunu korur). [29] Leucine (Lösin), ayrıca insülin salgılanmasını pankreasta uyararak (insülin daha sonra PI3K’yi aktive eder) muhtemelen pratik olarak uygun değildir.
- Akt / PI3K :Kas protein sentezini tetiklemek üzere aktive olan proteinler
- aPKC :Protein kinazlar, proteinlere fosfat grupları eklemek için kullanılır.
Ancak, insülinin bulunmadığı durumlarda 2mM Leucine (Lösin) ve metabolit α-ketoizokaproat, PI3K / aPKC (tipik olmayan PKC [30] ) yoluyla glikoz alımını arttırdığı ve mTOR’dan bağımsız olarak (mTOR’u bloke ederek etkiler). [31] Bu çalışma sadece uyarımı 15-45 dakika boyunca 15-45 dakika (60 dakika içinde direnç gelişti) olarak kaydetti ve potens ile bazal insülinin fizyolojik konsantrasyonları ile karşılaştırılabilir, ancak 100 nM insülin kadar düşük performans gösterdi (güçlü olarak% 50). [31] Bu etki mekanizması, izolösine benzer ve biraz benzer potensiyele benziyor.
- AMPK :5 ‘AMP ile aktive olan protein kinaz veya AMPK veya 5’ adenosin monofosfatla aktifleştirilmiş protein kinaz, hücresel enerji değişiminde rol oynayan bir enzimdir.
- S6K :Hücre büyümesi ve G1 hücre döngüsü ilerlemesi için gerekli olan RSK ailesinin bir AGC kinazıdır. Fosfoinositid 3 kinazın (PI3K) akış aşağısında, mitojenik yollarda mTOR ile fosforillenir ve aktive edilir.
- IRS-1 :İnsülin sinyal iletiminin anahtar bir aracıdır.
Bununla birlikte, Leucine (Lösin), AMPK sinyalini doğal olarak bastıran mTOR sinyalleşmesinin aktivasyonu ile ilişkili olduğu düşünülen hücresel glukoz alımını [32] [33] [34] engelleyebilir [35] (AMPK sinyallemesi, glikoz alımına aracılık eden düşük hücresel enerji ve egzersiz periyotları). [36] [37] S6K üzerinde etkili olan mTOR sinyallemesi ile kombinasyon halinde; mTOR / S6K ile sinyalizasyon, IRS-1’in proteazomal bozunmasını aktive etmek suretiyle veya sadece doğrudan IRS-1’e bağlanarak IRS-1’in (insülin kaynaklı etkilerin ‘sinyalini taşıyan ilk protein) parçalanmasına neden olacaktır. [39]
- Proteazom :Peptit bağlarını kıran bir kimyasal reaksiyon olan proteoliz ile istenmeyen ya da hasar görmüş proteinleri bozan protein kompleksleridir.
Bu, insülin sinyalizasyonunun negatif geri bildirim kontrol döngüsünü oluşturur. [40] IRS-1 üzerindeki olumsuz etkilerin engellenmesi, Leucine (Lösin) ile uyarılan glukoz alımı [41] ve bu negatif geri besleme, glukozun neden 45-60 dakika tutulduğunu ve aniden bastırabildiği açıklar. [31] izolösin, mTOR’u aktive etme ve dolayısıyla bu negatif geri bildirim yolunu daha az kuvvetli olduğu için, izolösin ancak Leucine (Lösin), kas hücrelerinde kayda değer glikoz alımına yol açar.
Leucine (Lösin) başlangıçta yaklaşık 45 dakika boyunca kas hücrelerine glikoz alımını teşvik etmektedir ve daha sonra genel etkilerini biraz azaltan kendiliğinden kesmektedir. ‘Kesme’ normalde mTOR aktivasyonundan sonra oluşan olumsuz bir geribildirimdir. İzolösin mTOR’nun daha az aktivasyonu nedeniyle glukoz alımını arttırmada Leucine (Lösin)’den daha iyidir.
4.2 İnsülin Salgılama
Leucine (Lösin), metabolitleri KIC vasıtasıyla pankreastan insülin salgılanmasını uyarabilir ve bu insülin salınımı, diğer iki BCAA ve iki benzer dallı amino asit (norvalin ve norLösin) tarafından bastırılır. [42] 10 mM’de potens, glikozun yaklaşık % 73’üdür. [42]
- KIC (α-ketoglutarat asit) : Lösin için metabolik yoldaki metabolik ara maddelerdir.
Genel olarak, Leucine (Lösin) insülin salgılanmasını uyarmada glikoz ile ek veya sinerjiktir (örneğin, Leucine (Lösin) ve glukoz ile birlikte görülen% 170 ve% 240 artış, kombinasyon [43] ile% 450’ye yükseltilir). Leucine (Lösin) ve yohimbine‘in karşılaştırılabilir potenslerden olmasına rağmen, örtüşen mekanizmalara sahip oldukları için katkı maddesi değildirler. [43]
Leucine (Lösin), pankreastan insülin salgılanmasını uyardığı bilinir ve bunu yaparken en güçlü BCAA gibi görünür. Eşmolar temelde (bir hücre içindeki molekülün aynı konsantrasyonu), Leucine (Lösin), yaklaşık olarak yohimbin kadar güçlü fakat glikozun kendisi kadar güçlü olduğu için yaklaşık üçte ikisidir.
Leucine (Lösin), bazı amino asitleri α-ketoglutarata dönüştürebilen bir enzim olan glutamat dehidrogenaz (GDH) ‘nın pozitif bir allosterik düzenleyicisidir. [44] [45] Bu dönüşüm, hücresel ATP konsantrasyonlarını arttırır (ADP’ye göre) ve ATP seviyelerindeki artış, mTOR aktivasyonundan bağımsız mekanizmalarla insülin salgılanmasında bir artışa neden olur. [46] [47]
- ATP : Kas protein sentezini tetiklemek üzere aktive olan proteinler
Metabolit KIC hem KATP kanallarını [48] bastırabilir hem de pankreatik β hücrelerinde kalsiyum salınımlarını tetikleyebilir. [49] [50] Kalsiyum salınımı ayrıca mTOR (standart Lösin hedefi) [15] üzerinde etki yapabilir ve mTOR aktivasyonu α2A reseptörlerinin ekspresyonunu baskılayabilir. [43] α2A reseptörleri etkinleştirildiğinde insülin salınımlarının bastırıcıları olduğu ve aşırı ekspresyonu uyaran diyabet olduğu için bu reseptörlerin daha az sentezlenmesi, insülin salgılanmasında nispi bir artışa neden olur.[52]
- α2A reseptörü : Norepinefrin (noradrenalin), negatif geri besleme şeklinde serbest kalmasını engelleyen damarsal kavşağın üzerinde bulunur.
MTOR zıttı olan rapamisin, Leucine (Lösin’in) uyarıldığı insülin salgılanmasını ortadan kaldırabildiği ve insülin salgılanmasını kendi başına bastırabildiği için bu yol, pratik açıdan daha önemli bir olasılıktır. [53] [54]
Leucine (Lösin), pankreatik beta hücrelerden insülin salgılanmasını uyarmak için iki yol izleyerek çalışır, ancak ana yol, negatif bir regülatörün (α2A reseptörlerinin) etkisinin azaltılmasından kaynaklanmaktadır. Negatif regülatörün etkisinin azaltılması, aktivitede refrakter artışa neden olur.
5 İskelet Kası ve Fiziksel Performans
5.1 Protein Sentezi
Leucine (Lösin)’in birincil etki mekanizması mTOR [55] [56] aktivitesini uyarır ve bu daha sonra p70S6K’nın PDK1 vasıtasıyla aktivitesini uyarır ve p70S6K daha sonra kas protein sentezini pozitif olarak kontrol eder. [12] Ayrıca Leucine (Lösin), ökaryotik başlatma faktörünün (eIF, özellikle eIF4E) aktivitesini indirebilir ve protein dönüşümünü arttıran [58] [59] inhibitör bağlayıcı proteinini (4E-BP1) bastırır ve oral alımın ardından doğrulandı. [60]
Bu şekilde eIF modülasyonu, p70S6K tarafından uyarılan kas protein sentezini arttırır ve mTOR aktivasyonu, aynı zamanda egzersize (kısa süreli olarak değil, 1-2 saatlik bir zaman gecikmesinden sonra), insüline ve kalorik bir fazlalığa bağlı ortak bir anabolik yoldur. [64]
- mTOR : Kas protein sentezini tetiklemek üzere aktive olan proteinler
- p70S6K : Hücre büyümesi ve G1 hücre döngüsü ilerlemesi için gerekli olan kinazdır.
- PDK1 : İnsülin sinyallemesi dahil olmak üzere çeşitli büyüme faktörleri ve hormonlar tarafından aktive edilen sinyal yollarındadır.
- eIF4E : eIF4E aktivitesi, göğüs, akciğer ve prostat kanserleri dahil olmak üzere çeşitli kanserlerde rol oynamaktadır.
Diğer dallı zincir amino asitlere benzer ve insülinden farklı olan Leucine (Lösin), Akt / PKB aktivitesini (insülin reseptörü ile mTOR, Akt ve Protein Kinaz B / PKB arasında değişebilen terimler) uyarmaz. [11] [12] Akt, p70S6K tarafından uyarılan kas protein sentezini olumlu bir şekilde destekleyen eIF2B’yi de geliştirebilir ve dolayısıyla Akt’in Leucine (Lösin) tarafından aktivasyon eksikliği teorik olarak Akt sinyali de yükseltilirse insülin gibi daha az kuvvetlidir.[65] [66]
Leucine (Lösin)’den mTOR aktivasyonu, oral eklemeyi takiben insan dokusunda ve p70S6K aktivasyonunda doğrulandı. [67] [68] Akt aktivasyonu araştırılmış ve insan kasında aktivitede herhangi bir değişiklik bulmada başarısız olmuştur, [11] bu da pankreastan püsküren insülin salınmasının Leucine (Lösin) tarafından uyarıldığı ortaya koymaktadır (insanlarda ve insülin Akt aktive eder) ilgili olmayabilir.[69]
Leucine (Lösin), mTOR aktivitesini ve bunun ardından gelen protein sentezi sinyalizasyonunu uyarır. Akt / PKB, mTOR aktivitesini olumlu olarak etkilese de (bu nedenle Akt aktive edildiğinde mTOR’yı harekete geçirir) Lösin, Akt’i etkilemeden mTOR’u farklı bir yolla işler gibi görünür. Ne olursa olsun, mTOR’yı aktive eden herhangi bir şey p70S6K’yi aktive edecek ve ardından kas protein sentezini teşvik edecektir.
Leucine (Lösin)’in bu anabolik etkisi, iskelet kasının karaciğer (karaciğer) dokusundan daha fazla olduğu görülmektedir [70] ve bazı çalışmalar, Leucine (Lösin)’in bir egzersiz programına önceden yüklenmesinin diğer zamanlardan daha etkili olduğunu düşündüren, fiziksel egzersizle (kas kasılmaları) [71] artırıldığı görülmektedir (aşırı protein sentezinde). [72] [73]
Leucine (Lösin), kas protein sentezini uyaran tüm amino asitlerin en güçlü olduğu görülmektedir. [74]
5.2 Atrofi / Katabolizma
Leucine (Lösin), laboratuvar ortamında düşük konsantrasyonlarda kas protein sentezini geliştirirken, atrofiyi hafifletmek için daha yüksek konsantrasyonlara ihtiyaç duyar; sentez oranlarına plaktan yerleştirmeye rağmen. [75]
- Atrofi :Kas atrofisi kas kütlesinde azalma olarak tanımlanır.
Bu kas koruyucu etkisi, kan zehirlenmesi, yanıklar ve travmanın yanısıra kanser gibi kas kaybı ile karakterize hastalık hallerinde de kaydedilmiştir. [76] [77] Bu senaryolarda faydaların doza bağımlı olduğu görülmektedir.[78]
5.3 Hyperaminoacidemia
Hiper (aminoasit) emia, kandaki (-emia) aşırı miktardaki (hiper-) amino asitleri ifade etmek için kullanılan bir terimdir ve buna benzer şekilde, hiperürezinemi, özellikle çok fazla Leucine (Lösin) anlamına gelir.
Yaşlı erkeklerde, Leucine (Lösin)’in, kas protein sentezini, hiperaminoasidemiden bağımsız olarak arttırdığı keşfedilmiştir. [20]
5.4 Sarkopeni
Sarkopeni, iskelet kas kitlesi protein içeriğinde bir azalma ve yaşlanma ile ortaya çıkan iskelet kası yağ içeriğinde bir artış ile karakterizedir. Sarkopeninin neden olabileceğine ilişkin nedenlerden birisi, hücresel yaşlanmada L-Leucine (Lösin)’in kas koruma etkilerine karşı metabolik yanıtta bir azalmaya bağlı olmasıdır. [79] Bu etki kısmen, protein içeren gıdalara L-Leucine (Lösin) ilave edilerek reddedilebilir. [80] [81] [82]
6 Besin-Supplement Etkileşimi
6.1 Karbonhidrat
İnsülin reseptörü etkinleştirildiğinde, mTOR’u Akt yoluyla aktif hale getirebilir. Akt, S6K1’in uyardığı protein sentezini pozitif yönde etkilemekle birlikte (mTOR aktive edildiğinde aktive olur) insülinin laboratuvar ortamında yaptığı gibi,[67] [68] Leucine (Lösin) takviyesinin doğrudan Akt aktive etmediği anlaşılmaktadır. [11] [12] İnsanlarda Leucine (Lösin) damardan alımı iskelet kasında önemli ölçüde aktive olmamış olduğu gösterilmiştir, bu da Leucine (Lösin) tarafından uyarılan insülin salgılanmasının Akt’i uyarmak için yetersiz olduğunu göstermektedir.[69]
- mTOR /Akt : Kas protein sentezini tetiklemek üzere aktive olan proteinler
Leucine (Lösin), daha fazla pankreas insülini salgılanması salınmasına ikincil kan glukozunu düşürmede glukoz ile sinerjik bir şekilde çalıştığı bulunmuştur. [84] [43] İlginçtir, Leucine (Lösin), örtüşen mekanizmalara bağlı olarak insülin salgılanmasını uyarmakta yohimbinle ilâve değildir. [43]
Leucine (Lösin), pankreasyondan insülin salgılanmasını arttırmada diyetteki karbonhidrat ile sinerjik görünmektedir ve kas proteini sentezinin ilerletilmesinde insülin ile sinerjik görünmektedir.
6.2 Resveratrol
Resveratrol, lösine benzer sirtuin proteinleriyle (çoğunlukla SIRT1) etkileşen bir şarap fenoliktir; 0.5 mM’de KIC ve HMB’nin metabolitleri, 2-10μM resveratrol ile karşılaştırılabilir bir potens olan [25] lösine (0.5mM) veya HMB (0.5μM) ve resveratrol (200nM) hem yağ dokularında hem de iskelet kası hücrelerinde SIRT1 ve SIRT3 aktivitesini sinerjik olarak uyarabilmektedir. [85] a-Ketoizokaproik asit , HMB’den daha güçlü bir uyarıcı gibi görünmektedir [25] ve sinerjizm, Leucine (Lösin) ile birlikte HMB’den (muhtemelen a-Ketoizokaproik asit metabolizmasının göstergesi) daha fazla görünmektedir. [85]
- SIRT1 :NAD-bağımlı deasetilaz sirtuin-1 olarak da bilinen Sirtuin 1, insanlarda SIRT1 geni tarafından kodlanan bir proteindir.
Sıçanlara lösin (kontrol diyetinin% 24’üne kadar) (24g / kg, kontrol diyetinin% 200’üne kadar) veya resveratrol (12.5 veya 225mg / kg) ile HMB (2 veya 10g / kg) ve daha sonra aç bırakılmış durumda ve azalmalarla yağ kütlesinde ve vücut ağırlığında da sinerjik gözükmektedir. [85]
Resveratrolün Leucine (Lösin) veya HMB ile kuluçkaya yatırılmasının AMPK aktivitesini (sırasıyla% 42-55) arttırdığı ve 5mM glukoz ile kuluçkalanmaya rağmen yağ oksidasyonunda mütevazı bir artış (% 18) belirtilmektedir. [85]
Resveratrol ve Leucine (Lösin) her ikisi de mitokondriyal biyojenezeyi SIRT1 aktivasyonu yoluyla olumlu olarak etkilerler ve ikisi de birlikte kuluçkalandığında veya birlikte alındığında sinerjik görünürler.
6.3 Sitrülin
Sitrülin farelerde yaşlanma ve yetersiz beslenme sırasında kas protein sentezi hızlarını [86] [87] ve kas fonksiyonunu [88] restore ettiği görülmektedir ve bu, mTORc1 yolu ile (rapamisin olarak bilinen mTORc1 inhibitörü tarafından ortadan kaldırılmıştır) aracılık edilmektedir. [89] [90]
İnsan çalışmaları için, 0.18g / kg sitrulin’in bir hafta boyunca takviye edilmesi, Leucine (Lösin) oksidasyon hızlarını veya tüm vücut proteini sentezini önemli ölçüde değiştirmede başarısız olmuştur. [91] Ancak beslenme durumunda insanlarda nitrojen dengesini iyileştirmek için aynı dozda başka yerlerde belirtilmiştir; bu çelişkinin nedeni bilinmiyor.[92]
Sitrülin’in mTOR üzerindeki doğrudan aktivasyonuna bakan çok fazla kanıt bulunmamakla birlikte, mTOR sonrasında (4E-BP1 de dahil olmak üzere) proteinleri zayıf bir şekilde Leucine (Lösin)den daha az uyardığı görülmektedir. [86] Sitrülinin avantajları mTOR’a bağımlı olduğu için mTOR sinyallemesini arttırdığı, bu durumda Leucine (Lösin) ile sinerjik olması gerektiği akla yatkındır; bu doğrudan araştırılmadı.
Sitrülin teorik olarak sinerjik olduğunu öne süren mTOR vasıtasıyla Leucine (Lösin) sinyalizasyonuna aracılık edebilir. Ağırlık kaldırıcılara yönelik kombinasyonun uygulanması henüz araştırılmadı, bu nedenle sinerji, gösterilen bir gerçek değil, şu an sadece bir hipotezdir.
7 Güvenlik ve Yan Etkiler
7.1 Genel
5 sağlıklı erkekte küçük bir çalışmada 1,250 mg / kg’ya kadar dereceli Leucine (Lösin) alımı (tahmini ortalama gerekliliğin 25 katı) verilen 500-1,250 mg oral dozların kan amonyak artışına neden olduğunu ve bunun sonucunda üst sınırın 500 mg / kg’da (150 libre insan için, 34 g) kurulmalıdır. [93]
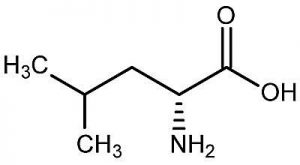
Moleküler Formül: C6H13NO2
Moleküler Ağırlık: 131.175 g / mol
(Leucine için yaygın yazım hataları arasında loocine, lucine, leucinbulunur)
Bilimsel Destek ve Referans Metni
Leucine (Lösin) Referanslar
- Lipitlerden ve lösinden gelen ketojenik akı, 3-hidroksi-3-metilglutaryil CoA liyaz eksikliğinde değerlendirme .
- Sıçanlarda farklı bölgelerden gelen adipoz doku ile lösinden Keton vücut sentezi .
- İnsan karaciğerinde bir alfa-ketoizokaproat oksijenaz ile beta-hidroksi isovalerat oluşumu .
- Dallanmış Zincir Amino Asitlerin İskelet Kası Üzerine Nutrasötik Etkileri .
- Lösin ve alfa-ketoizokaproatın in vivo beta-hidroksi-beta-metilbutirat’a oksidasyonu .
- Büyüme ve metabolizmada TOR sinyalizasyonu .
- mTOR, hücre büyüme mekanizmasına sinyal veren, besleyici duyarlı bir kompleks oluşturmak için raptor ile etkileşir .
- mTOR Complex1-S6K1 sinyallemesi: obezite, diyabet ve kanser kavşağında .
- hVps34, p70 S6 kinazın aktivasyonu için gerekli olan bir besleyici-düzenlenmiş lipit kinazdır .
- Amino asitler, sınıf 3 fosfatidilinositol 3OH-kinaz aktivasyonu yoluyla mTOR / raptor sinyalleşmesine aracılık eder .
- Lösin ve insülin, insan iskelet kasındaki farklı yollardan p70 S6 kinazı aktive eder .
- Dallanmış zincirli amino asitler, fiziksel egzersizden sonra protein sentezinde anahtar enzimleri aktive eder
- Kalsiyum tarafından diferansiyel regülasyon, Akt ve p70S6k aktivasyonu için farklı sinyal gereksinimlerini ortaya çıkarır .
- S6K1’in (p70 ribozomal protein S6 kinaz 1) aktivasyonu, yüksek moleküler kütleli bir sinyalleşme kompleksinin oluşturulmasını içeren bir başlangıç kalsiyum-bağımlı priming olayını gerektirir .
- Amino asitler, hVps34’e Ca2 + / CaM sinyali ile mTOR kompleks 1’i aktive eder .
- S6 kinaz 1 sinyallemesinin besleyici-duyarlı kontrolünde SHP-2 için yeni rol .
- SHP-2, iskelet kaslarının büyümesini desteklemek için aktive edilmiş T hücrelerinin nükleer faktörünün sinyalleşmesini aktive eder .
- SHP-2, mTOR / S6 kinaz 1 yolunu kontrol ederek hücre büyümesini düzenler .
- Rheb GTPase, TSC2 GAP aktivitesinin doğrudan bir hedefidir ve mTOR sinyalini düzenler .
- Lösin takviyesi yaşlı erkeklerde hyperaminoacidaemia’dan bağımsız olarak kas protein sentezini geliştirir .
- Mitokondri’nin Sirtuin regülasyonu: enerji üretimi, apoptoz ve sinyalleşme .
- Kalori kısıtlaması, SIRT1 ve metabolizma: uzun ömürlülüğü anlama .
- Calorie kısıtlaması – SIR2 bağlantısı .
- SIRT1 fonksiyonel olarak metabolik regülatör ve transkripsiyonel koaktivatör PGC-1 {alpha} ile etkileşime girer
- Adipositlerde ve kas hücrelerinde süt tüketiminin SIRT1 ve mitokondriyal biyogeneze etkileri .
- Süt bileşenlerinin farelerde enerji bölümleme ve metabolik risk üzerindeki etkileri: bir mikrodizi çalışması .
- AP2-agouti ve vahşi tip farelerde diyetsel kalsiyum ve oksidatif stres ve mortalitenin süt modülasyonu .
- İskelet kas hücrelerinde ve adipositlerde mitokondriyal kitle ve oksijen tüketiminin lösin modülasyonu .
- Amino asitler ve lösin, wortmannin ile tedavi edilen normal adipositlerde ve db / db farelerinden adipositlerde PKB / mTOR yolağının insülin aktivasyonuna izin verir .
- Atipik protein kinaz C-lambda ve atipik protein kinaz C-zeta’nın F-aktin hücre iskeletinin Ras-aracılı yeniden düzenlenmesine katıldığına dair kanıt .
- Lösin sıçanların iskelet kaslarında glukoz alımını artırır .
- Lösin, oruç sırasında iskelet kaslarında glikoz ve piruvatın oksidasyonunu inhibe eder .
- Hiperaminoasemiemi, sağlıklı insanda insülin aracılı glikoz atımını azaltır .
- Dört gün oruç insan gönüllülerde insülin aracılı glikoz kullanımının kısa süreli regülasyonu: amino asit mevcudiyetinin rolü .
- Lösin, adenosin monofosfatla aktive olan protein kinazın inhibisyonu yoluyla kısmen C2C12 miyoblastlarındaki rapamisin sinyalizasyonunun memeli hedefini uyarır .
- AMP ile aktive olan protein kinazın enerji algısı ve kas metabolizması üzerindeki etkileri .
- AMPK ve Egzersiz: Glikoz Alım ve İnsülin Duyarlılığı .
- Rapamisin yolunun memeli hedefi insülin sinyalini, insülin reseptör substratının (1) hücre altı yeniden dağıtımı yoluyla düzenler ve beslenme sinyallerini ve insülinin metabolik sinyallerini birleştirir .
- IRS-1 Ser-1101’in besinsel ve obezite kaynaklı insülin direncinde S6K1’in bir hedefi olarak tanımlanması .
- mTOR / p70 S6 kinaz yolu üzerinden amino asit ve insülin sinyali. İskelet kas hücrelerinde insülin direncine yol açan bir negatif geri besleme mekanizması .
- Rapamisin duyarlı bir yol insülin sinyalini, fosforilasyon ve insülin reseptör substrat-1’in proteazomal bozunması yoluyla aşağı regüle eder .
- Pankreatik adacık metabolizması ve insülin sekresyonu üzerine dallı zincirli amino asitler ve keto asitlerin etkileşimi
- Lösin böbrek transplantasyonunda yeni başlangıçlı diyabette mTOR (rapamisin memeli hedef) yolu yoluyla adrenerjik a2A reseptörünün yüzey ekspresyonunun aşağı regülasyonu yoluyla insülin sekresyonunu uyarır .
- L-lösin ve metastabolize olmayan bir analog, pankreatik adacık glutamat dehidrogenazı aktive eder
- Hiperinsülinizm / hiperammonemi sendromu: amonyak metabolizmasında glutamat dehidrojenazın düzenleyici rolüne dair bilgiler .
- Glukokinaz ve ATP sentazının lösin regülasyonu, pankreatik beta hücrelerinde glukozla indüklenmiş insülin sekresyonunu duyarlı hale getirir .
- Lösin kültürü, ATP sentazının pankreas beta hücrelerinde bir yakıt sensörü olarak işlev gördüğünü ortaya koymaktadır .
- Alfa-ketoizokaproat ile pankreas beta hücresi ATP tarafından düzenlenmiş potasyum kanalının doğrudan inhibisyonu .
- Adacık hücre kümelerinde sitoplazmik Ca2 + ölçümleri glikozun hızla beta hücrelerini aldığını ve bireysel hücre yanıtını kademeli olarak artırdığını göstermektedir .
- Amino asitle indüklenen insülin salınımının uyarıcı-sekresyon bağlanması: lösin metabolizması ve katyonik etkileri .
- Pankreatik beta hücrelerinde alfa2A-adrenoseptörlerini aşırı eksprese eden transgenik fareler, glikoz homeostazının değiştirilmiş düzenlemesini göstermektedir .
- Alfa2A-adrenerjik reseptörlerin aşırı ekspresyonu, tip 2 diyabetlere katkıda bulunur .
- Rapamisin, karbohidrat metabolizmasını baskılayarak sıçan pankreas adacıklarında metabolizma-sekresyon bağlayıcısını bozar .
- Rapamisin ile mTOR inhibisyonu, hiperglisemiye beta-hücre adaptasyonunu önler ve tip 2 diyabetin metabolik durumunu şiddetlendirir .
- Leucine, rapamisine duyarlı bir yolla, postalarorptif sıçanların iskelet kasında translasyonun başlatılmasını uyarır
- İnsanlarda Rapamisin uygulaması, iskelet kası protein sentezinde kasılmanın neden olduğu artışı engeller .
- PDK1 tarafından p70s6k’nin fosforilasyonu ve aktivasyonu .
- El ele: eIF4E’yi hedefleme .
- Dallanmış zincirli amino asitler ile protein sentezinin düzenlenmesi .
- Oral olarak uygulanan lösin, artan eIF4F oluşumu ile birlikte, postalardaki hormonlu sıçanların iskelet kasında protein sentezini uyarır .
- Direnç egzersizi AMPK aktivitesini artırır ve insan iskelet kasında 4E-BP1 fosforilasyonunu ve protein sentezini azaltır .
- Direnç Alımı, Rapamisin-bağımlı Manner Memeli Hedefinde Eukaryotik İnisiyasyon Faktörü 2B mRNA’nın Kas Protein Sentezini ve Tercümesini Artırır .
- Akt / PKB substrat PRAS40’ın aracılık ettiği mTOR’a insülin sinyali .
- Metformin, bir metabolik sendromun domuz modelinde iskemik kardiyak dokudaki insülin sinyal yolunu değiştirir .
- İskelet kası hipertrofisine ve atrofiye aracılık eden sinyal yolları .
- Memeli hücrelerinde peptit-zincir uzamasının düzenlenmesi .
- Leucine insanlarda tüm vücut ve iskelet kas protein metabolizmasının bir düzenleyicisi olarak .
- İnsanlarda lösin infüzyonunun hücre içi amino asitlere etkisi .
- Pankreatik beta hücrelerinden insülin sekresyonunun düzenlenmesinde lösin metabolizması .
- Lösin oral uygulaması, sıçanların karaciğerinde protein sentezinin küresel oranlarını değil, ribozomal protein mRNA translasyonunu uyarır .
- Direnç egzersizi ve lösin artı proteinin yutulmasıyla kas anabolizminin uyarılması .
- Net kas protein sentezinin egzersiz öncesi ve sonrası peynir altı suyu proteini ile uyarılması .
- Amino asit-karbonhidrat alımının zamanlaması, kasın direnç egzersizine karşı anabolik yanıtını değiştirir .
- Lösin Takviyesi Egzersiz Sırasında Sıçanlarda İskelet Kası İyileşmesini Artırır .
- L-leusinin potansiyel antiproteolitik etkileri: in vitro ve in vivo çalışmaların gözlemleri .
- Kanser kaşektik farelerde kas kütlesinin korunmasına lösin takviyesinin doz bağımlı etkileri .
- Yanık, travma ve sepsiste dallı zincirli amino asitlerin terapötik kullanımı .
- Atrofik koşullarda lösin takviyesinin iskelet kası üzerindeki terapötik etkilerine genel bir bakış .
- Amino asitler ve yaşlanma ile birlikte kas kaybı .
- Lösin takviyeli bir diyet, yaşlı sıçan iskelet kasındaki proteazom bağımlı proteolizin defektif postprandiyal inhibisyonunu geri yükler .
- Yaşlılarda esansiyel amino asitler tarafından kas protein sentezinin hızının en iyi şekilde uyarılması için yüksek oranda lösin gereklidir .
- On gün boyunca lösin takviyeli yemek besleme, eski sıçanlarda postprandial kas protein sentezini yararlı bir şekilde etkiler .
- İnsülin direnci mekanizmaları: yaygın dişler ve eksik bağlantılar .
- Lösin, glikoz ile yutulduğunda sinerjistik olarak insülin sekresyonunu uyarır ve kan şekerini düşürür .
- Adipositlerde ve farelerde lösin ve resveratrolün insülin duyarlılığı ve yağ metabolizması üzerindeki sinerjik etkileri .
- Lösin ve sitrülinin, esansiyel olmayan amino asitlere karşı aç bırakılmış sıçanlarda kas protein sentezi üzerindeki etkileri: ortak bir aktivasyon yolu .
- Citrulline, eski malnütrisli sıçanlarda kas protein metabolizmasını modüle eder .
- Yetersiz beslenen sıçanlarda lösin ve sitrülin kas fonksiyonunu modüle eder .
- Sitrülinin kas protein sentezi üzerine doğrudan etkisi: mTORC1 yolunun rolü .
- Leucine ve citrulline: iki protein regülatör regülatörü .
- Sağlıklı insan gönüllülerinde oral sitrülin tüm vücut protein metabolizmasını etkilemez: prospektif, randomize, çift kör, çaprazlama çalışmasının sonuçları .
- İnsanlarda sitrulin kullanılabilirliğinin manipülasyonu .
- Genç erkeklerde akut diyet çalışmalarında lösin toleranslı üst alım seviyesinin belirlenmesi .
- 12 haftalık bir ağırlık antrenman programı sırasında acemi adaylarına günlük L-lösin takviyesi .