
Marijuana (Esrar) Nedir Ve Ne İşe Yarar ?
Marijuana (Esrar), psikoaktif özelliklerinden dolayı dünyada kullanılan bir bir bitkidir. THC olarak bilinen başlıca bileşeni, kısa süreli yararlara sahiptir ancak hızlı toleransa tabidir. Ayrıca, Kannabinol gibi psiko-olmayan bileşenler kronik faydalar gösterebilir. Tedavi için, bitki her derde deva değildir.
Editör Notu: Burada sadece bilimde nasıl kullanıldığı ve insan vücuduyla nasıl etkileşime girdiği bilimsel bir şekilde anlatılacaktır.Doktor gözetimi olmadan kullanılması oldukça yıkıcı olabilir.
Özet
Tüm Temel Faydalar / Etkiler / Gerçekler ve Bilgiler
Marijuana (Esrar) , sativa, indica, ve ruderalis dünyanın her yerindeki psikoaktif özellikleri için kullanılan birkaç bitkinin ortak adıdır. Marijuana (Esrar) iltihaplı hastalıkları tedavi etmek için geleneksel olarak kullanılmaktadır.
Günümüzde Marijuana (Esrar), kanseri tedavi eden diğer ilaçların yanında kullanıldığı anlamına gelen bir yardımcı kanser terapisi olarak kullanılmaktadır. Tıbbi Marijuana (Esrar) kullanımı ağrıyı hafifletebilir ve iştah artabilir. Ayrıca iltihaplanma ve romatoid artrit gibi kronik rahatsızlıklar üzerindeki etkileri nedeniyle araştırılıyor.
Marijuana (Esrar) dumanını teneffüs etmek kalp kan basıncını ve kalp atış hızını arttırır, ancak bu değişiklik geçicidir. Bununla birlikte, Marijuana kullanımını kalp krizinden 30 ile 60 dakika önce not eden birçok vaka incelemesi bulunmaktadır. Kalp krizi riski yüksek kişiler kan basıncını ve kalp atış hızını tehlikeli seviyelere çıkardığında ortaya çıkabilir. Marijuana (Esrar) aynı zamanda bazı ilaçlarla etkileşime girebilir ve kan basıncının yükselmesine ve kalp krizine neden olabilir. Marijuana (Esrar) sigara biçiminde kullanma bronşit ile ilişkilendirilmiştir.
Marijuana (Esrar) ve Δ 9 THC veya delta-9 tetrahidrokanabinol ile iyi araştırılmış, çünkü bunlar aslında bitkiden sonra adlandırılan vücuttaki kanapinerjik sistem üzerinde etkili oluyorlar. Bu sistem, kanabinoid reseptör tipi 1 (CB1) ve kanabinoid reseptör 2 (CB2) adı verilen iki reseptör tarafından düzenlenir. CB1, Marijuana (Esrar) maddesinin psikoaktif etkilerinin çoğundan sorumludur ve CB2, Marijuana (Esrar) maddesinin iltihaplanma ve ilgili hastalıklar için sağlayabileceği uzun vadeli faydalardan sorumludur.
Marijuana (Esrar) kullanımı uzun süre boyunca toleransa ve daha sonra geri çekilmeye neden olabilir. Marijuana (Esrar) geri çekilmesi Zihinsel Bozuklukların Teşhis ve İstatistik El Kitabı (DSM-5) tarafından tanınmaktadır. Moleküler düzeyde, Marijuana (Esrar) toleransı, CB1 reseptörü aşırı uyarılır ve içe akıtıldığında, yani hücre tarafında emildiği anlamına gelir.
CB1 reseptörü ve NMDA reseptörü, Marijuana (Esrar) olduğunda birbirine bağlıdır, bu yüzden CB1 sinyali engellendiğinde, NMDA sinyallemesi de engellenir. Bu Marijuana’ın epilepsi ve şizofreni tedavisinde daha az etkili olmasına neden olur, ancak Marijuana (Esrar) kullanımı ile ilişkili hafıza kaybını da azaltır. Tolerans CB2 reseptörünü önemli ölçüde etkilemez, bu yüzden Marijuana iltihaplı hastalıklar için daha uzun süre etkili olabilir.
Son olarak, yüksek Kannabinol ürünler, yüksek Δ 9 THC ürünlerinden çok terapötik etkiler için düşünülmektedir. Öncelikle TRP’ler olarak bilinen kalsiyum kanalları üzerinde hareket etmesi nedeniyle Kannabinol ve diğer psişikonaktif olmayan kanabinoidlerin, Δ 9 THC’nin başarısız olduğu alanlarda terapötik kullanımları olduğu düşünülmektedir. İnsan kanıtı şu an eksik olsa da, yüksek Kannabinol ürünleriyle oldukça güçlü terapötik etkiler önermek için makul kanıtlar var gibi görünüyor.
Bilmen Gerekenler
Ayrıca şöyle bilinir
Marijuana Sativa , Ot, Tıbbi Marijuana , uyuşturucu, ganja, hashish, Dronabinol (tıbbi THC),Kenevir,Hint Keneviri
Şaşırmayın
Marijuana Proteini (aynı bitki, ancak bu terim THC içermeyen bir gıda ürününe gönderme eğilimindedir)
Aşağıdakiler İçin Kullanılır
- Ruh hali
- Ayrıca için kullanılır
- Bilişsel İşlev ve Beyin Sağlığı
Aşağıdakinin Bir Şeklidir
İlaç veya Farmasötik
Aşağıdaki İle İyi Gitmez
- Kafein (Kafeine tolerans, Marijuana kullanırken uzamsal bellek oluşumunda bozulmaya neden olabilir)
- Kardiyak uyarıcılar (Marijuana ile görülen kalp kan basıncında ve kalp atım hızında bir artışa bağlı olarak, kalp krizi riski taşıyanlar için bu kombinasyon çok tehlikeli olabilir)
Dikkat Edilmesi Gerekenler
- Marijuana (Esrar) hem oral hem de inhale yolla yüksek düzeyde psikoaktiftir
- Marijuana (Esrar) motor kontrolünü ve dikkatini azaltabilir (ağır makine çalıştırmadan önce solunmamalıdır)
- Marijuana (Esrar) maddenin CYP3A4 ve CYP2C19 içeren birçok metabolizma enzimi ile etkileştiği bilinir.
Dikkat uyarısı
Marijuana (Esrar), bölgeye göre değişen yasal bir statüye sahiptir ve tıbbi amaçlı değilse, bölgenizde yasadışı olabilir (dereceleri değişebilir).
| KANIT DÜZEYI | SONUÇ | NOTLAR | ||
|---|---|---|---|---|
| Kan basıncı | Yeni bir kullanıcıda tek bir kullanım kalp kan basıncını artıracaktır (vücut kan basıncı üzerinde gerçek bir etkisi yoktur) ve bu toleransa tabidir. Ağır kullanıcılar artık bu Kısa süreli artışı yaşamayacak ve bunun yerine kalp kan basıncında bir düşüş gösterebilirler. | |||
| Serebral kan akışı | Beynin tümünde hem artışlar hem de azalmalar bildirilmiş gibi görünmektedir ve esrardan ortostatik hipotansiyon yaşamamış kişilerde genellikle bir artış olduğu görülmektedir; Özellikle ACC’ye kan akışı THC’den sonra artmaktadır, ancak bu tolerans sırasında bir azalmaya dönüşmektedir. | |||
| Kalp hızı | Kalp tansiyona benzer şekilde, kalp hızı değişiklikleri toleransa tabidir. Yeni kullanıcılar düşük kalp atış hızı ile birlikte artan kalp debisi ile karşılaşabilir ve hafif egzersiz sırasında kalp atış hızı artabilir, kronik kullanıcılar bu etkilere toleranslı hale gelir. | |||
| Beyin Motor kontrolü | Kısa süreli kullanım, Beyin motor kontrolünü ve ince koordinasyonunu azaltabilir, ancak bu, toleransa tabi olabilecek bir etkidir (hoşgörülü kullanıcılar esrar kullandıktan sonra herhangi bir fark görmemektedir). | |||
| Ağrı | Esrar dozunda psikoaktif etkiler sağlayan ağrılarda azalma olduğu görülüyor. | |||
| Multipl Skleroz Belirtileri | Bilişsel belirtilerin esrar kullanımı ile henüz ele alınmadığı halde, esrar kullanımı ile fiziksel belirtiler ve onlara ikincil bazı parametreler (yorgunluk, enerji, uyku kalitesi) yararlanabilir. | |||
| Gevşeme | Psikoaktif etkileri konan doz ve zaman, gevşemenin kontrol altına alınandan daha büyük bir oranda olduğu ile ilişkilidir. | |||
| Aerobik egzersizi | Maksimum altı (hafif) aerobik egzersiz performansının fazla etkilendiği görülmemekle birlikte aerobik egzersiz yorulmaya çalışıldığında esrar kullanımı kontrol ile karşılaştırıldığında daha az dayanıklılık ile ilişkilendirilmiş gibi görünüyor. | |||
| Baş dönmesi | Baş dönmesi, özellikle Marijuana ile ortostatik hipotansiyon geçiren kullanıcılar için bir yan etki olarak bildirilmiştir; aksi takdirde baş dönmesi üzerinde büyük bir etkisi yoktur. | |||
| ghrelin | Esrar kullanımıyla, muhtemelen iştah artışında rol oynayan ghrelinde bir artış kaydedildi. | |||
| İdrar kaçırma | Multipl sklerozlu olgularda ikincil bir veri analizinde, idrar kaçırma yan etkisi Marijuana kullanımı ile azaltılmış olabilir gibi görünüyor. | |||
| Leptin | Esrar kullanımı ile bir kez leptin artışı kaydedildi. | |||
| Akciğer fonksiyonu | Sigara içme başına negatif görülürken THC’nin infüzyonu akciğer fonksiyonlarını arttırır ve eklemlerin dezavantajlardan daha çok akciğer fonksiyonuna fayda sağladığı için esrar kullanır. | |||
| Peptid YY | İştah ile olan etkileşimine bağlı olduğu düşünülen esrar kullanımı ile serum peptide YY’da bir azalma kaydedilmiştir. | |||
| Reaksiyon süresi | Esrar kontrolünde Kısa süreli kullananlarda reaksiyon süresinde bir azalma gözlemlenmiştir. Doğrudan test edilmemesine rağmen, tolerans esnasında bunun zayıfladığı düşünülmektedir. | |||
| Uyku kalitesi | Multipl skleroz tedavisinde fiziksel semptomlara bazı faydalara ikincil olarak uyku kalitesinin plaseboya göre arttığı kaydedildi. | |||
| Orthostatik Hipotansiyon Belirtileri | Tüm kullanıcıları etkilememekle birlikte, bazı yeni kullanıcılar , beyindeki kan akışının küresel olarak azalmasıyla(beklenen artıştan ziyade) ortostatik hipotansiyon belirtileri yaşayabilir; | |||
| Çalışma belleği | Kısa süreli çalışma belleği etkisinde iken esrar kullanan yeni kişilerde azalır, ancak esrar toleransı esnasında bu engelleyici etkinin devam etmediği görülür. | |||
| Dikkat | Esrar kullanıcıları, esrar içerken herhangi bir dikkat azalması yaşamazlar. | |||
| Kan akışı | Kalp debisi ve kalp kan basıncındaki değişiklikler olmasına rağmen, Marijuana Kısa süreli kullanımının kan akışını kontrol ile ilişkili olarak etkilediği görülmemektedir. | |||
| Vücut ısısı | Vücut ısısı üzerinde önemli bir etkisi yoktur. | |||
| Biliş | Multipl skleroz sırasında kullanıldığında, bilişsel işlevin genel bir puanı, esrar tedavisi ile büyük ölçüde (olumlu ya da olumsuz) etkilenmiş gibi görünmemektedir. | |||
| Depresyon | Multipl skleroz semptomu olarak görülen depresyon, esrar tedavisinden önemli ölçüde etkilenmiş gibi görünmemektedir. | |||
| Yorgunluk | Multipl skleroz için esrar kullanımında fiziksel ve zihinsel yorgunluk ile ilgili karışık kanıtlar, yararları düşündüren daha fazla çalışma istatistiksel olarak anlamlı değildir. | |||
| İnsülin | Kısa süreli esrar kullanımı dolaşımdaki insülin konsantrasyonlarını etkilemez. | |||
| Sinirlilik | Multipl sklerozun yan etkisi olarak sinirlilik, esrar tedavisinden önemli ölçüde etkilenmiş gibi görünmemektedir. | |||
| Bellek | Genel bellek oluşumu, esrar kullanımından önemli ölçüde etkilenmiş gibi görünmemektedir. | |||
| Güç çıkışı | Esrarın kısa süreli solunması , kontrole göre test edildiğinde kavrama gücünü değiştirmede başarısız olmuştur. | |||
| Göziçi Basıncı | Esrar solunması Göziçi kan basıncını oldukça önemli ölçüde düşürmekte ve glokom vakalarında faydalı olmaktadır. | |||
| Toplam vücut suyu | Hastaneye yatan hastalarda kilo almanın yanı sıra toplam vücut suyundaki artış kaydedildi; Bilinen bir serbest dolaşım kullanıcısı için pratik önem. | |||
| Ağırlık | Hastaneye yatırılan hastalarda kronik THC’nin ağırlığı arttırdığı belirtildi; bu bilgilerin hastaneye yatan hastalarla ilgili epidemiyolojik araştırmalardan farklı olduğuna (herhangi bir değişiklik yapılmadığına ya da kiloda gözle görülür bir azalma olduğuna) dikkat edilmelidir. | |||
| Nefes Alma Oranı | Nefes alma hızı esrar kullanımıyla doğal olarak değişmiş gibi görünmüyor. | |||
| Kortizol | Esrarın idrar kortizolü üzerinde belirgin bir etkisi olduğu görünmüyor. | |||
| VO2 Max | Dayanıklılığın azalmasına rağmen, gruplar arasında ölçülen VO2 max fark göstermedi. | |||
| Görüş keskinliği | Glokoma THC ile tedavisi sırasında görme keskinliği engellenmiş gibi görünmüyordu. |
1 Kaynaklar ve Kompozisyon
1.1 Tarihi ve Kompozisyon
Marijuana (Esrar) (çoğunlukla sativa, indica ve ruderalis türleri Marijuana (Esrar) cinsindeki bitkilere atıf yapan bir terim) ayrıca, çeşitli beslenme dışı ve tıbbi olmayan amaçlar için kullanım öyküsü olan Geleneksel Çin Tıbbından bir bitkidir. Tarihi, Mısır mumyaları (haşhaş olarak) ile birlikte tespit edildiği için anakara Asya’nın ötesine uzanıyor. [3]
Bitki, Marijuana (Esrar) (bitki kendisine atıfta bulunularak), bhang (yapraklardan ve çiçeklerden [4] bazı Asya ülkelerinde üretilen bir içkiye gönderme yapan) ve hashish (reçineli bir çözüme gönderme yapan) olmak üzere birçok ad olarak adlandırılır. Bitkinin tüm parçaları, genellikle yapraklar ve çiçek tomurcukları olmak üzere eğilimlidir. [5]
Marijuana sativa (Cannabaceae ailesi) biraz geniş bir bitki türüdür ve Marijuana (Esrar) cinsindeki daha önceki türler ( Marijuana (Esrar) kaynağının yanı sıra Marijuana ruderalis olan Marijuana indica ) şimdi Marijuana sativa çeşitleri olarak kabul edilmektedir. [6] Marijuana sativa’nın farklı kemotipleri vardır; bir ilaç fenotipi (% 9’u aşan bir Δ 9 THC ile tanımlanır), Marijuana ürünleri (% 0.3 Δ 9 THC veya daha düşük) ve bir ara tip (0.3 -1% Δ 9 THC). [6] [7] Lif tipi, ilaç istismarına karşı potansiyellerini engellemek için ticari Marijuana proteini veya Marijuana yağı takviyeleri oluşturmak için kullanılır.
Marijuana (Esrar) şu anda dünyada BM’ye göre en yaygın kullanılan yasadışı maddedir [8] ancak yasal olarak çeşitli kanser türleri, AIDS / HIV ve nörolojik bozukluklar için terapi ya da destek gibi tıbbi tedavi olarak verilebilir (iştahı, besin alımını ve dolayısıyla ağırlığı artırır). [9] [10]
Marijuana (Esrar), tıbbi özelliklerinden ötürü başlangıçta kısmen yayılmış olan geleneksel bir Çin tıbbıdır, aynı zamanda Marijuana fabrikasından imalat için malzeme kullanmak için de geçerlidir. Halen bazı tıbbi öneme sahip olsa da bugünlerde en çok bilinen ve psikoaktif özellikleri için kullanılmıştır.
Genel olarak Marijuana sativa bitkisi çok çeşitli biyoaktif maddeler içerir, ancak ilgi çekici olanlar kanabinoidlerdir. Marijuana (Esrar) sativa bağlamında kanabinoidler, şu anda 86’dan fazla benzersiz molekülün izole edildiği C21 terpenofenol iskeletine [11] sahip molekülleri belirtmektedir. [11] [6] [12] Bilinen unsurlar aşağıdakileri içerir:
Kanabinoidler (örneğin Fitokannabinoidler):
- Tetrahidrokannabinol Δ 9 (Δ 9 THC) tipi: Bu, ana psikoaktif (-) – trans- (6aR, 10aR) Δ 9- tetrahidrokanabinolü (genellikle Δ 9 THC’ye kısaltılmış, ancak özellikle Δ 9 THC-C 5 olarak anılır) [11] şunları içermektedir; Kısaltılmış yan zincir varyantları, örneğin tetrahidrokanabinol C4 (Δ9 THC- C4); [11] asit varyantları, tetrahidrokanannik asit A (Δ9 THCA-C5A), [11] tetrahidrokanabinolik asit B (Δ9 THCA-C5B), [11] tetrahidrokanabivarinik asit A (Δ9 THCVA-C3A [11] ve tetrahidrokannabiorkolik asit (Δ9 THCOA-C1A / B); [11] ve diğer varyantlar tetrahidrokanabivarin (Δ 9 THCV-C 3) [11] ve tetrahidrokannabiorcol (Δ 9 THCO-Cı)[11]
- Tetrahidrokannabinol Δ 8 (Δ 8 THC) tipi: Δ 9 THC’den çift bağın konumu ve Δ 8 (6aR, 10aR) tetrahidrokanabinolik asit A’nın sadece iki varyantı (Δ8-THCA-C5A [11]) ve Δ 8 (6aR, 10aR) tetrahidrokanabinol (Δ8-THC-C5) [11] mevcut olduğu bilinmektedir
- Kannabinol (CBN) türü: THC tipi kanabinoidlerin tam aromatizasyonundan oluşturulmuştur. Buna kanabinolik asit A (CBNA-C5A), [11] kanabinol (CBN-C5) [11] ve metil eter (CBNM-C5), [11] kanabinol-C4 ] , kanabinool-C2 (CBN -C2) [11] kanabiorol-C1 (CBN- C11) [11] ve kanabisarin (CBN-C3) [11]
- Kannabidiol (CBD) tipi: kannabidolik asit (CBDA-C5 [11]), (-) – kannabidiol (CBD-C5 [11]) ve bunun monometil eteri, kannabidiol C4 (CBD-C4 [11]), kanabidivarinik asit ( CBDVA-C3 [11]), (-) – kannabidivarin (CBDVA-C3 [11]) ve kannabidiorcol (CBD-C1 [11])
- Kannabitriol (CBT) tipi: Bunlar arasında (+) – trans-kannabitriol-C3 (+) – cis , (+) – trans ve (-) – trans konfigürasyonlarında (CBT-C 5), [11] kannabitriol (CBT-C 3), [11]. 8,9-dihidroksi-Δ6a (10a) tetrahidrokanabinol (8,9-Di-OH-CBT-C5), [11] ve 10-etoksi-9-hidroksi türevleri [11] [13] [14] aittir
- Kannabidiol (CBND) tipi: CBD tipinin tam aromatizasyonunda oluşur, şu an sadece kanabinodiol (CBND-C 5), [11] ve kanabinodivarin (CBVD-C 3), [11] varlığı bilinmektedir.
- Kannabigerol (CBG) tipi: klasik anlamda psikoaktif değil (Marijuanaya atfedilen etkiler) [15]ve monometil eter olan kanabiberol (E -CBG-C) ile kanabiberolik asit A (E -CBGA-C5A) [11] 5 ] ve monometil eter, kanabiberovirinik asit A (E -CBGVA-C3A), [11] kanabiberovarin (E -CBGV-C3), [11] ve kanabinerolik asit A (Z -CBGA-C5) [11] [16]
- Kannabikromen (CBC) tipi: Bunlar çoğunlukla rasemik kanabinoidler kanabichromenik asit ( CBCA – C5A ), [11] kanabikromen (CDC-C5), [11] kanabikromevarinik asit (CBCVA-C3A), [11] kannabichromene varin (CBCV-C 3), [11] kannabikromen (CBCV-iC3 [ll] ) ve 2-metil-2- (4-metil-2-pentenil) -7-propil-2H-l-benzopiran-5- [11]
- Kannabisiklol (CBL) tipi: Kanabisiklolik asit (CBLA-C5A), [11] kanabisiklol (CBL-C5), [11] dahil olmak üzere (+) – (1aS, 3aR, 8bR, 8cR) konfigürasyonunda bilinen üç kanabinoid ve kanabisiklovarin (CBLV-C 3), [11]
- Kannabielsoin (CBE) tipi: Bunlar, doğal kaynaklarda nadiren tanımlanır ve Kannabinol tipinden foto-oksidasyon ile üretilebilir, bu kanabinoidlerin hepsi (5aS, 6S, 9R, 9aR) konfigürasyonundadır ve kanabielsoik asit A (CBEA- C 5 A), [11] kanabielsoik asit B (hem CBEA-C 5 B hem de CBEA-C 3 B), [11] ve kannabielsoin (CBE-C 3 ve CBE-C 5) [11]
(Diğer) Yukarıdaki gruplardan birine ait olmayan Marijuana sativa’da bulunan kanabinoidlerin, dehidrokanabifuran (DCBF-C 5), [11] kanabifuran (CBF-C 5), [11] kanabikromanon (CBCN-C5) [11] , kanabikromanon-C3 (CBCN-C3), [11] kanabisukmaronon (CBCON-C5), [11] kanabisitan (CBT-C5 ), [11] 10-oxo- Δ6a (10a) tetrahidrokanabinol (OTHC), [11] cis konfigürasyonu Δ9THC (cis Δ9THC-C5), [11] kanabiglendol (OH- iso -HHCV-C3), [11] ve izetetrahidrokanabivarin C3 ve C5 [11]
Not : Her molekül için yukarıdaki kısaltmalarda koyu renkli bileşen (ör. CBT), kanabinoidin ait olduğu yapısal alt sınıfı belirtirken A, bir asit (karboksilasyon) ve M, bir monoetil eter ilavesi anlamına gelir. C x, omurgadaki bir karbon zincirinin uzunluğunu belirtir.
Marijuana (Esrar) esnasındaki Δ 9 THC içeriği çok değişebilir. Δ 9 THC içeren sigara kullanan birçok çalışma,% 4.8 Δ 9 THC içeriğine sahip ürünler kullanmaya eğilim gösterirken, modern yaygın sokak Marijuanası % 7-9 Δ 9 THC içermektedir. [17] [18]
Bu içerik geçmişte olduğundan önemli derecede yüksektir, zira 1980 Marijuana ,% 1.5 Δ 9 THC içeriğine sahiptir ve zamana bağlı olarak istikrarlı bir şekilde artmıştır. [19] [18] Ağırlık itibariyle% Δ Δ9 THC bildiren, evde yetiştirilmiş bir Marijuana (Esrar) türü bulunmaktadır. [17] Marijuanayla olduğu gibi, zamanla artan ortalama Δ 9THC içeriği eğilimi de hashish’e kadar uzanıyor. [17]
Marijuana (Esrar) tüketiminde bulunan ve tüm bitki özütünün idaresinin etkilerine katkıda bulunabilecek 70’den fazla kannabinoid bulunur. Bunlardan, ana kanabinoid (-) – trans- (6aR, 10aR) Δ9-tetrahidrokannabinol (bundan böyle sadece Δ9THC) olan araştırma için saf halde bulunabilen ilk yüksek derecede psikoaktif olandır.
Diğer (kanabinoid olmayan) olası biyoaktif maddeler:
- Uçucu yağlar (genellikle aromaterapide kullanılan havadaki bileşenler) genellikle yüksek konsantrasyonda myrcene (% 29.4-65.8 toplam esansiyel yağ [20] [21]) ve ardından Limonen (bazen% 16.3-17.7 [21] ‘e kadar) ve Linalool, trans-okimen, a-pinen, β-pinen ve β-caryophyllene (bunun kendisi de kannabinoid aktivitesine sahiptir) içeren çeşitli daha az bileşen [22])
- 4,5-dihidroksi-2,3,6-trimetoksi-9,10-dihidrofenantren , 4-hidroksi-2,3,6,7-tetrametoksi-9,10-dihidrofenantren ve 4,7-dimetoksi- 1,2,5-trihidroksifenthren [23]
- Kannabispiranollar, örneğin α-kanpaispiranol [23] ve β-asetil kannabispiranol [23]
- Cannaflavin A [23] ve C [23]
- Chrysoeriol (biyo flavonoid) [23]
- 6-prenilapigenin (prenilatlı apigenin) [23]
Kanabinoid olmayan bileşenler, büyüme durumuna ve kullanılan Marijuana ait türüne bağlı olarak değişir, ancak Δ 9 THC’nin aksine, yaygın olarak nicelenmedikleri için Marijuana biyolojik etkilerine katkısı belirsizdir. Δ 9 THC ve diğer kanabinoidler (esas olarak Kannabinol ) en aktif bileşenler olmaya devam etmektedir.
1.2 Fizikokimyasal Özellikler
Çift bağ izomerinin (-) – trans-6a, 10a-Δ8 THC’nin biyolojik açıdan aktif ancak zayıf (-) – trans Δ 9 -THC varyantı olduğu söylenebilir, bu sadece karbonlar arasındaki çift bağın konumu 9 ve 10 (Δ 9 THC) veya 8 ve 9 (Δ 8 THC). [24]
Tetrahidrokannabinol , bir delta (Δ) işareti ile etiketlenen belirli izomere bağlı olarak yer değiştirebilen bir çift bağa sahip olan bir terpenoid bileşiktir.
2 Farmakoloji
2.1 Sindirim
Pasif teneffüs, Marijuana (Esrar) jeneratöründen alınan ikinci el solunum teneffüsünü ifade eder ve Marijuana (Esrar) kullanması yasaklanan birçok sporcu, Marijuana (Esrar) kullanıcısı ile ilişkiye girebilir, bu da yanal akım dumanına maruz kalmayı pozitif idrar testleri için endişelendirir. [25] Yanal duman maruziyetinin idrardaki Δ 9 THC için pozitif bir sonuca neden olup olmadığı da önemlidir, çünkü bu, pozitif test ile yüz yüze olanlar tarafından kullanılan temel bahanedir. [26]
Δ9THC metaboliti (11-Nor-9-Karboksi-Δ9-Tetrahidrokanabinol veya THCCOOH) (idrarda 15 ng / mL’den büyük) için olumlu bir sonuç genellikle pasif soluma ile ortaya çıkmaz ve yan yana esrar dumanına maruz kalmış olabilecek atletlerle ilgili olmadığı düşünülür. [25] Havalandırılmayan bir odada bile, altı gün boyunca günde dört esrar (% 2,8 Δ9THC) fümesine maruz kalmanın idrar THCCOOH’de güvenilir bir artışa neden olduğu gösterilmemiştir.[28]
Benzer bir ortamda bir saatten fazla dört esrar fümesi, 80 üriner örnekten [29] tek bir pozitif sonuç (3.9ng / ml) ve eğlence Marijuana kullanımına herhangi bir olumlu test sonucuna neden olmadı. [30]
İdrar THCCOOH havadaki Δ 9 THC miktarı ile ilişki olduğundan, olumlu bir sonuç zorlanabilir. [28] Havalandırılmamış küçük bir odada, bir saatte 16 esrar fümesine maruz kalmak pozitif bir idrar testine neden olabilir, ancak bu, yüksek duman yoğunluğundan dolayı gözlüklerin gerçekten görmesi için gerekli olan bir miktar esrar dumanıdır. [28] Sadece bu son örnekte, Marijuana’nın psikoaktif etkileri, kullanmayan tarafından hissedilmektedir. [28]
Marijuana (Esrar) kullananlar tarafından ikincil (pasif) Marijuana (Esrar) solunmasından pozitif bir idrar testi yapmak mümkün olsa da, bu, kişinin aslında gözle görülmesi için gözlük takmak için yeterince kalın dumanlı sıcak bir kutu içerisinde bir saat bekletilmesini gerektirir. Tüm gerçekçi durumlar da dahil olmak üzere Marijuana kullanımının diğer koşulları, pozitif testi yapmak için pasif bir inhaler için yeterince maruz kalmış gibi görünmüyor.
Tetrahidrokannabinol (THC), etanol içeren solüsyonlar ile laboratuvar ortamında transdermal THC emiliminde başarılı olduklarını belirten bazı çalışmalarla birlikte uygun bir ortamda (yağda eriyebilir olduğu zaman) deri yoluyla veya propilen glikol ile emilir gibi gözükmektedir.[33] [34] [35] [36]
Geçirgenlikteki bu artış hem THC hem de Kannabinol için geçerlidir. [35] Bununla birlikte, lipofilisite daha düşük olması nedeniyle ikincisi THC’den daha geçirgen görünmektedir. [36] Fare derisi insan derisine göre daha geçirgen iken, [33] kobay faresi derisi insanlarda geçirgenlik açısından çok benzerdir. [37]
Emilimdeki türlere bağlı farklılıklara rağmen, THC’nin, fare ve kobay farelerde laboratuar ortamında topikal olarak emildiği not edilmiştir, ikincisi, 70 saat boyunca 4.4 ± 0.9 ng / mL’lik (etanol ve propilen glikol içeren bir çözeltide 8 mg THC içeren bir yama ile) bir plazma konsantrasyonuna ulaşmak için 84 dakikalık bir gecikme süresi gösterir.
THC cildin yolu ile emilebilir, ancak emilimi sınırlıdır. Sindirim, diğer maddelerle arttırılabilir ve en azından kobaylarda, vücudu düşük fakat uzun süreli THC seviyelerine maruz bırakacak yamalar açıklanmıştır. Düşük emilim oranları ve serumda herhangi bir büyüklüğe sahip zirve seviyede bulunmaması nedeniyle, herhangi bir kayda değer psikoaktif etki, transdermal sindirim yoluyla olası değildir.
2.2 Serumda Taşıma
Marijuana (Esrar) füme edilirse (içe çekerek), kanabinoidlerin maksimum bir plazma değeri elde edilir ve birkaç dakika içinde psikotropik etkilerin başlangıcı olur. Psikotropik etkiler ilk yem alımından 15-30 dakika sonra maksimaldir ve maruz kaldıktan 2-3 saat sonra hafifletilir. [39] Sistemik biyoyararlanım, % 10 ± 7 [40] ile % 27 ± 10 [41] aralığında değişirken, alışılmış kullanıcılar aktif THC’yi daha çok sindirir. Düşük biyoyaralanımının nedeni, ısıl bozunum, zayıf akciğer emilimi ve yanal akım dumanına sindirilmemek için kaybedilen hipotezi en fazla% 30’dur. [39] Boru şeklindeki kullanımı, yanal akış kayıplarını gidermekte ve% 45’e varan sindirim oranları kaydedilmiştir. [42]
Oral sindirimden sonra (çikolatalı kekler yoluyla) en yüksek serum seviyeleri, insanlar arası değişik sindirim potansiyeline sahip olduklarından, alımdan 60-120 dakika sonra bir değişkende elde edilir. [39] [43] Bazı çalışmalar, enjeksiyon sonrası 4-6 saatlik zirve değerlerinin gecikmelerine dikkat çekmiştir; bazıları çoklu plazma zirveleri sergilemektedir. [45]
Bir yağlı asit aracı ile, radyoaktif işaretlenmiş THC’nin (hem aktif Delta-9 formu hem de asit hidroliz ürünü Delta-8 [46] içeren bağırsak alımı), çoğu durumda% 90’ı aşar. [43] Hepatik ilk geçiş metabolizması, sistemik dolaşım için mevcut miktar, bireylerarası farklılıklar yüksek olan% 2-14 arasında değişir. [47] [39]
Oftalmik (göz) uygulaması sadece hafif bir mineral çözeltisinin, uygulamadan 1 saat sonra% 6-40 sistemik biyoyararlanım ve en yüksek serum seviyesi ile sonuçlanan ve birkaç saat boyunca yüksek kaldığı tavşanlarda araştırılmıştır. [48]
2.3 Periferik Dağılım
THC’nin doku konsantrasyonunu etkileyen bariyerlerin veya THC’ye özgü taşıyıcıların bulunmadığı için, THC’nin doku dağılımının molekülün fizikokimyasal özelliklerine bağlı olduğu varsayılmaktadır. [49] [39] Asimile THC’nin yaklaşık% 10’u kırmızı kan hücrelerine [50] bağlanırken, diğer% 90’ı da lipoproteinler gibi plazma proteinlerine ve daha nadiren albumin’e bağlanmaktadır. [51] [52] THC’nin lipofilik özelliği (yağda çözünürlüğü) nedeniyle, hücre membranlarından kolayca dağılabilir.
THC, kas, dalak, kalp, akciğerler, karaciğer ve böbrekler gibi vaskülarize (iyi kan kaynağı) dokulara ve organlara hızla girer. [53] Lipofilliği nedeniyle, sonunda yağ dokusuna (vücut yağı) yerleşir ve burada uzun süre kalabilir. [54] [55]
THC, plasental bariyeri kolaylıkla geçebilir ve bir anne Marijuana (Esrar) içerse, çocuğun kanında görünebilir; Bu, tüm türler arasında değişen derecelerde görülür. [56] [57] [58] Anne sütü, plazmada bulunan 8.4 kat THC seviyesini içerebilir ve bu nedenle, bir annenin günde 1-2 eklem eklemi çocuğunu 0,01-0,1 mg aktif THC arasında değişen değerlere maruz bırakabilir. [59]
THC ayrıca üreme işlevini etkileyebilecek testislerde birikebilir. [53]
2.4 Metabolizma
Her ne kadar akciğerlerde ve kalp dokusunda metabolizma mevcut olsa da, tetrahidrokanabinoidler öncelikle karaciğerde sitokrom P450 (CYP) enzim sistemi yoluyla hidroksilasyon ve oksidasyon reaksiyonları yoluyla metabolize edilir. [60] [61] CYP2C alt ailesinin bir üyesi insanlarda en aktif gibi görünüyor. [62]
- P450 : Başta karaciğerde olmak üzere bilirubin gibi ilaçlar ve endojen metabolizma ürünleri dahil olmak üzere potansiyel olarak toksik bileşikleri metabolize etmeye yarar.
THC’nin 100’ün üzerinde ayrı metabolitleri tanımlanmış olmakla birlikte, esas ürün, THC’nin C-11’de hidroksilasyonu ile 11-OH-THC’yi oluşturur ve THC-COOH’ye daha da oksitlenir. [64] THC metabolitlerinin çöküşüne karaciğer P450 enzimleri aracılık ediyor, hız sınırlayıcı adım hepatik kan akımı gibi görünüyor. [39] [65]
THC metabolitleri, idrarda, THC-COOH’un bir glukuronidat formu olan asit metaboliti 11-nor-9-karboksi-THC glukuronid yoluyla yaygın olarak atılır. [66] Önerilen uzun süreli depolama mekanizması, 11-OH-THC’nin yağ hücreleriyle yağ dokusu içinde birleşmesidir. [67]
İdrar ve dışkılardaki THC bileşiklerinin atılımı dokularla plazma arasında bir denge sağlandıktan sonra başlar. Denge süresi, 3-12 saat süren düşük doz (16mg THC) füme ve 6-27 saat süren yüksek doz (34mg) füme ile doza göre değişir. [68] Karboksillenmiş metabolit (THC-COOH), her iki dozajdan sonra 7 gün boyunca plazmada tespit edilebilir. [68]
Metabolizma için bu uzun süre kısmen, yağ ve diğer vücut dokularından kan dolaşımına THC konjugatlarının yavaş salınmasıyla açıklanmaktadır ve kısmen çeşitli THC konjügatlarının yarılanma ömrü nedeniyle kısmen de bilinmemekle birlikte, 11-OH-THC için 12-36 saat ve THC-COOH için 25-55 saat aralığındadır. [49]
20-30 saatlik aralıktaki yarılanma ömrü genellikle THC molekülünün kendisi için bildirilir. [69] [41] THC metabolitleri tipik olarak ana THC molekülünden daha uzun yarılanma ömrüne sahiptir. Komplikasyonlar Delta-9-THC’nin yarı-ömrünü kişiler arası ve türler arası farklılıklara göre ölçmekte ortaya çıkar ve THC’yi metabolitlerinden laboratuvar ortamında ayıran bazı komplikasyonlar mevcuttur.
THC’nin atılımı esasen ana molekül yerine asit metabolitleri olarak gerçekleşir ve% 20-35 idrarla atılır ve% 65-80’i dışkılardan atılır. [43] [65] THC dışkısının atılması, molekülün yağda çözünürlüğüne, kapsamlı karaciğer-bağırsak yeniden dolaşım ve böbrek tübüllerden emilimine bağlanabilir.[43] [70] THC ve THC metabolitlerinin yaklaşık% 65’i her iki rotadan 72 saat sonra atılır. [39] [43]
THC’nin vücudun tamamen ortadan kaldırılması iki hafta sürebilir. [44] Ayrıca kronik ve ilk kez kullanıcılar arasında farklılıklar var gibi görünüyor. Kronik kullanıcılar, tüm THC’yi vücuttan tamamen metabolize etmek için daha uzun sürebilir; bazı durumlarda idrar analizi altında metabolit idrardan idrardan sonra 46-77 güne kadar izlenebilir. [71] Ortalama vücuttan atılım süreleri, hafif kullanıcılar için 12.9 gün ve kronik kullanıcılar için 31.5 gün olarak bildirildi.
2.5 Vücuttan Atılımı
Esasen karaciğer yoluyla dışkı atılımını önermekte olan kanabinoidlerin lipofilisitesine rağmen, kanabinoidler de idrarda elimine edilmek eğilimi göstererek Marijuana (Esrar) bırakma duyarlılığını tespit etmenin güvenilir bir yolu olarak Δ 9 THC metabolitlerinin idrar tahliyesine yol açmaktadır. [72] Hem de kan testi hem de saç testi de araştırılmıştır.[72] [73]
Δ 9 THC’nin vücut yağında (adipoz) biriktiği bilinmekte olup bir çalışma, iki gün boyunca iki eklem uygulanan ağır kullanıcılarda (tahmini 56 mg  9 THC alımı) inhale Δ 9 THC’nin 0.4 -8.0ng / g Δ 9 THC yağ depositlerinde dört haftadan fazla kaldı. [54]
Δ 9 THC vücut yağında düşük konsantrasyonda bir ay veya daha fazla süreyle tutulabilir.
2.6 Faz I Enzim Etkileşimleri
Sigara bırakma (Marijuana (Esrar) veya tütün), CYP1A2 aktivitesinde artışa neden olabilir, ancak bırakma düzeylerini normale döndürdüğü bilinmektedir. Marijuana (Esrar) tüketimini durdurmaktan dolayı azalmış karaciğer enzim aktivitesinin, metabolizmada azalma nedeniyle bazı antipsikotiklerin (klozapin ve olanzapin) aşırı dozda sonuçlandığı belirtilmektedir. [74] [75]
Laboratuvar ortamında test edildiğinde, her üç enzim (CYP1A1 / 2 ve CYP1Bl), hem Kannabinol hem de Δ 9 THC ile rekombinant şekilde engellenir; bunlar, Kannabinol ile kaydedilen en güçlü CYP1A1 bastırması (IC50, 537 nM) hem CYP1A2 hem de CYP1B1 bastırılmıştır; potansiyel olarak kanabinol (CBN) ile 188nM ve 278nM sırasıyla. [76] Bununla birlikte, Kannabinol’ün CYP1A1 üzerindeki etkilerinin enzimatik inaktivasyon ile NADPH’ye bağlı bir şekilde ilişkili olduğu gösterilmiştir. [76]
- IC50 : Bir maddenin belirli bir biyolojik veya biyokimyasal işlevi bastırma gücünün bir ölçüsüdür.
- NADPH : Hücre dışı boşluğa bakan hücreye bağlı bir enzim kompleksidir.
- Ki değeri : Ki, bir inhibitörün ne kadar güçlü olduğunun bir göstergesidir.
Δ 9 THC, 2.47 uM (CYP1B1) ile 7.54μM (CYP1A2) aralığında rekabet engelleme için bir Ki değerine sahip CYP1 izoformlarını bastırma bakımından daha zayıftır. [76]
Marijuana (Esrar) içilmesi CYP1 enzimlerinin ekspresyonunu arttırır. Laboratuvar ortamındaki çalışmalar, Marijuana (Esrar) maddesinin bu enzimleri (CYP1A1, Kannabinol ile inaktive edildiğinde) kuvvetli bir şekilde bastırdığı ve CYP1 enzim sentezlenmesinin baskılanmış enzim aktivitesinin telafi mekanizması olabileceğini düşündürmektedir.
Kannabidiol, 2.51-8.70uM’lik (Yalnızca 793nM’nin Ki değeri) bir IC50 ile karışık bir CYP2C19 inhibitörü gibi görünmektedir. Rezorsinol kısmı üzerindeki fenolik hidroksil gruplarının, bu bastırma için çok önemli olduğu ve grubun bu molekül üzerinde (Δ9THC’de çok fazla değil) dönebildiğinden daha güçlü olduğu düşünülmektedir.[77] Kannabidivarin (Marijuana sativa’nın küçük bir bileşeni) de önleyici aktiviteye sahiptir. [77]
CYP2C19 , laboratuvar ortamındaki koşullarda test edildiğinde, hem Δ 9 THC hem de Kannabinol’ün nispeten düşük konsantrasyonları ile bastırılmış gibi görünmekte olup, olası ilaç-ilaç etkileşimlerini önermektedir.
Kanabinoidlerin CYP2C9’u, laboratuvar ortamında koşullarda test edildiğinde , 937-1,500 nM’lik bir K i’ye sahip olan Δ 9 THC ve 2.29 uM’lik warfarin hidroksilasyonunu bastırmakta IC50’ye sahip olması kuvvetle bastırdığı görülmektedir. [78] Dahası, Kannabinol 882-1,290nM ve Ki 50 4.8μM iken, [78] kanabinol (CBN) ve poliaromatik hidrokarbonlar nispeten daha zayıftır. Metabolizma bağımlı bastırması olan kanabinoidlerin hiçbirinde belirtilmediği belirgin bir şekilde görülmemiştir. [78]
CYP2C9, laboratuvar ortamında test edildiğinde tüm kanabinoidler tarafından bastırılır. CYP29c9 tüm P450 enzimlerinin yanı sıra CYP1 izoformlarının IC50 değerlerine (vekalet gücü ölçümü) kıyasla Marijuana (Esrar) tarafından engellendiği düşünülmektedir.
CYP2D6 hem Δ9THC (Çeşitli substrat metabolizmasının bastırılmasında 17.1-21.2 μM IC50 [79]) hem de CBD tarafından bastırılır ve CBD, (4.01-6.52μM [79] IC50) resorsinol kısmına bağlı olan daha güçlü bir rekabetçi inhibitördür. Bu önleme, test edilen poliaromatik hidrokarbonlardan (Marijuana (Esrar) solunmasında dumandan üretilen PAH’lar) 100 μM’yi aşan IC50 değerlerine kıyasla belirgin derecede yüksektir. [79]
İzoformları CYP2A6 ve CYP2B6 ile ilgili olarak, kanabinoidlerin, laboratuar ortamında (Ki, bu enzimin işlevini bastırmada 28.9-55μM arasında değişmektedir) CYP2A6’nın bastırılmasında nispeten zayıf etkileri olan, Δ9THC (2.81μM), kannabidiol(695nM) ve kanabinol (2.55μM) tarafından CYP2B6’nın belirgin bir şekilde bastırılmasında nispeten zayıf etkileri olan rekabetçi olmayan inhibitörler olduğu görülür
Bir hücrenin Kannabinol ve THC’ye yinelenen maruziyetinin, CYP2B ve CYP2C mRNA’nın uyarımı ile, ancak bu enzimlerin katalitik aktivitesinde laboratuvar ortamında görünür değişiklikler olmadan ortaya çıktığı belirtilmiştir. [81]
CYP2D6 ve CYP2A6’nın her ikisi de kanabinoidler tarafından engellenmiş olup, bunlar üzerinde Kannabinol ile rekabetçi bastırma ve üç kanabinoidin hepsi tarafından rekabetçi olmayan bastırma (diğerlerine kıyasla nispeten zayıf olmuştur) ile bastırılmıştır. Bununla birlikte, CYP2B6, laboratuvar ortamında her üç kanabinoid tarafından potansiyel olarak uyuşmaz bir şekilde engellenmiştir.
Resorsinol kısmı, hem Kannabinol metabolizmasına katılan başka bir enzim olan CYP3A4 hem de CYP3A5 ile rol oynar; çünkü sırasıyla 11.7μM ve 1.65μM IC50 değerleri ile Kannabinol bastırır. Bu, anlamlı olarak, IC50 değerlerine erişmek için 35uM üzerinde gerekli olan Δ9 THC ve kanabinolden daha etkilidir). [83]
CYP3A7, kannabinoidlerin üçü tarafından karışık bir şekilde, 23-31 uM aralığında IC50 değerleri ile karşılaştırılabilir dereceye kadar engellenmiştir. [83] Kannabinol’ün ayrıca laboratuvar ortamında test edildiğinde diğer P450 enzimleri arasında bir inhibitör CYP3A4 olduğu bildirilmiştir. [84] [85]
Kısa süreli enzim etkileşimlerini değerlendiren yukarıdaki bilgilerin aksine, CYP3A izoformlarının uyarılması, hücrelerin inaktive kanabinoidlere tekrar tekrar maruz kalmasıyla kaydedilmiş olmasına rağmen, CYP3A4 mRNA’sındaki ve protein içeriğindeki artış, laboratuar ortamında katalitik aktivitede önemli bir değişiklik olmamasına rağmen kaydedilmiştir. [81]
CYP3A ile metabolize olan iki kemoterapötik maddenin (irinotekan ve dosetaksel) testinden önce gece 15 günde bir günde bir kez, oral esrar sativa takviyesi verilen (1g,% 18 THC ve% 0.8 Kannabinol içeren çay olarak hazırlanan)[86] kanser hastalarında yapılan bir çalışma, 87] her iki ilaç için klirens veya AUC’de önemli bir değişiklik bulamadı. [88]
- AUC : Kullanılan modellerden hangilerinin sınıfları en iyi şekilde tahmin ettiğini belirlemek için sınıflandırma analizinde kullanılır.
Diğer insan kanıtları, Viagra ve Marijuana (Esrar) kombinasyonunun kalp krizi ile sonuçlandığı bir vaka çalışması ve antiretroviral tedavide HIV bulaşmış kişilerde yapılan bir çalışmada, iki haftalık dronabinol takviyesi olan bir vaka çalışması nedeniyle, CYP3A4’ün Kısa süreli bastırmasından şüphelenilmektedir (2.5 mg). Marijuana (Esrar) üçer kez teneffüs edilmesi, eğri altındaki ilaç alanında (AUC) anlamlı azalmalara yol açtı. [90]
Test edilen tüm kannabinoidler, laboratuar ortamında test edildiklerinde P450’nin CYP3A izoformlarının kısa süreli bastırıcılarıdır; en güçlü olanı, ayrıca CYP3A7’yi kuvvetli bir şekilde bastırdığı ve CYP3A4’ü etkisizleştirdiği görülmektedir. Bu kanabinoidlerle subkronik hücre tedavisi, CYP3A aktivitesinin dirençli bir uyarımına neden olduğu görülmektedir. İnsanlarda test edildiğinde kısıtlı kanıtlar, iki hafta boyunca tutarlı Marijuana (Esrar) kullanımı ile ilaç kinetiğini önemli ölçüde etkilemediğini göstermektedir.
3 Moleküler Hedefler
3.1 Kanabinoid Reseptörler
Marijuana Kanabinoid bileşenlerinin ana faaliyet alanı, Kanabinoid reseptör 1 (CB1) ve kanabinoid reseptör 2 (CB2) olarak adlandırılan kanabinoid reseptörleridir; bunlardan birincisi, psikoaktif etkileri modüle ettiği beynin çoğunlukta bulunduğu ve ikincisi iltihap ve bağışıklık tepkisini modüle ettiği çoğunlukla bağışıklık dokusunda bulmuştur. [91]
CB1 reseptörleri sinir dokusunda belirgindir, ancak aynı zamanda tiroid, adrenaller, mide-bağırsak sistem ve üreme organları gibi hipofiz ve periferal dokuda bulunur. [92] CB1 reseptörü için Δ 9 THC’nin afinitesi (bilinen yüksek afiniteli ligandların diplomalanması için Ki değeri tarafından tutulan) yaklaşık olarak 35-80nM’dir ve bu hem dahili kanabinoidlerden (veya ‘endo-kannabinoid’ler) anandamidden ( 60-540nM) ve 2-AG (60-470 nM). [91]
CB1 etkilerini G proteinleri ile bağlama yoluyla uygular. [91] Spesifik olarak, CB1 aşağıdakilere bağlanmıştır:
- Adenil siklaz üzerinde bastırıcı etkilere sahip olduğu bilinen Gi / o (aynı zamanda G proteini İnhibitörünü temsil eden Gi olarak da bilinir). [93] [93] Bu bağlanma ile CB1 aktivasyonunun, cAMP ile aktifleştirilmiş Protein Kinaz A (PKA) aktivitesinin yanı sıra, nitrik oksit sinyali üzerine MAPK ve karışık etkilerin aktive edilmesi ve voltaj kapılı kalsiyum kanallarının bastırma ve içe doğru- doğru akıma çeviren potasyum kanallarıdır. [94] Na + K + ATPaz aktivitesi CB1 aktivasyonu ile de arttırılabilir. [95] Tercihen CB1 ile birleşmiş olan bir alt tip, Gα i3 opiod sinyalizasyonunda da yer alır. [96]
- G i / o’ya kıyasla CB1’in selektif olarak daha az çift bağladığı (G protein Uyarlayıcı), adenil siklaz üzerinde uyarıcı bir etkiye sahiptir. [97]
- Δ9 THC sadece bu spesifik yolağı diğer CB1 ligandlarına göre zayıf olarak uyarırsada, fosfolipaz C yoluna bağlanmış olan ve artan hücre içi kalsiyumun oluşumuna neden olan G / 11’dir. [98] [99]
CB1 reseptörünün, Marijuana bakarken genellikle Δ9THC anlamına gelen herhangi bir ligand tarafından aktivasyonu, Marijuana’nın psikoaktif etkileri ile sonuçlanır. Bu reseptör G proteinleriyle birleşerek etki eder.
- MAPK : Bir mitojen ile aktive edilen protein kinazı, serin ve treonin amino asitlerine özgü bir protein kinaz türüdür.
CB2 reseptörleri çoğunlukla bazı beyin hücrelerini (glial hücreler) içeren bağışıklık hücrelerinde bulunur ve CB1 reseptörleri gibi, adenil siklaz oluşumunu bastıran ve MAPK yolağını etkileyen boğmaca toksine duyarlı GI / o proteinleriyle birleştirilir. [91] CB2, keratinositlerde de bulunmuştur; burada endorfinlerin salınmasını kolaylaştırırlar. [100] Δ 9 THC’nin CB2’ye olan ilgisi (K i olarak ), 4-75 nM aralığındadır ve bu da hem endokannabinoid anandamidden (280-1,900 nM) hem de 2-AG’den (150-1,400 nM) daha etkilidir. [91]
CB2 reseptörleri aynı zamanda G-proteine bağlı reseptörlerdir ve Marijuana’nın psikoaktif etkilerine aracılık etmez, bunun yerine çoğunlukla beyinde glial hücreler gibi bağışıklık hücreleri de dahil olmak üzere bağışıklık sisteminin düzenlenmesinde rol alırlar.
CB1 reseptörünün, dopamin D2 reseptörü, adenosin A2A reseptörü, ad2 adrenerjik reseptörü ve μ, κ ve δ opioid reseptörleri de dahil olmak üzere birçok farklı reseptörle heterodimerize olduğu (başka, belirgin, alıcı ile eşleşir), farklı sinyal yollarının aktifleşmesine yol açtığı belirtilmiştir. [101]
3.2 Diğer Reseptörler
CB1 veya CB2, verilmiş fare türlerinde tamamen bloke edildiğinde veya silindiğinde hala meydana gelen kanabinoidlerin bazı eylemleri vardır, ancak herhangi bir G-protein bağlı reseptörün eylemlerini önleyen boğmaca toksine karşı hassastır. (kannabinoidlerin, yukarıda bahsedilen iki kannabinoid reseptöründen biri olmayan reseptörlere doğrudan etki ettiğini düşündürmektedir.) Yukarıda anılan iki kanabinoid reseptörünün Δ 9 THC’nin bu reseptörler üzerinde çok az etkisi olduğu görülmektedir ve bu etkiler başlıca diğer dahili ve sentetik kanabinoidlerden görülmektedir.
- EC50 : Yarı maksimum tepki veren bir ilacın konsantrasyonudur.
[102] [103] Eski sanki yetim reseptörü (bilinen ligandları olmayan reseptörler) GPR55, bazı sentetik kanabinoidlere yanı sıra 2-AG (3nM ‘lik EC50) ve oleoiletanolamid (440nM) gibi çoğu endokannabinoidi yanıtladığı için böyle bir kanabinoid reseptörüdür. Bunun yanı sıra, Δ 9 THC (8 nM) bulunurken, Kannabinol sadece bir etkidaşlarıdır . [104]
GPR55, farelerde adrenal bezlerde, mide-bağırsak yolun bölümlerinde ve merkezi sinir sisteminde (CB1’den daha düşük seviyelerde olmakla birlikte) ifade edilir ve Gα 13 olarak bilinen G proteinine bağlandığı düşünülmektedir. [104] Bu reseptörün işlevi tamamen net değildir, ancak ön kanıt, bunun vasküler tonusunda rol oynayabileceğini ve bazı anti-iltihaplanma etkilere sahip olduğunu düşündürmektedir. [104]
Başlangıçta GPR55 gibi bilinen ligandlara sahip olmadığı için ‘yetim’ reseptörleri olan bazı G-protein reseptörleri, kanabinoid reseptörlerinin de tepki verdiği moleküller için afiniteye sahiptir. Dolayısıyla, kanabinoid sinyalizasyona tabi tutulabilirler.
Kanabinoidler (özellikle Δ 9 THC değil), bazı serotonin reseptörleri, kolinerjik, glutaminerjik ve GABAerjik ve glisinerjik reseptörlerin karışık bastırması veya potensiyasyonu üzerindeki bastırıcı etkileri de içeren çeşitli diğer reseptör fonksiyonlarını etkilediği bilinmektedir. [105] Her biri ilgili sinir iletimi alt bölümlerinde (Nöroloji bölümünde) daha ayrıntılı olarak ele alınmış ve bu reseptörlerin Cys-döngüsü ligand-kapılı iyon kanalı (LGIC) süper ailesi üyeleri oldukları için birbirlerine ortak olduğu görülmektedir . [106]
Cys-döngüsü ligand kapılı süper-ailesi, çeşitli kanabinoidler (bazen güçlendirilmiş olan glisin ve GABA reseptörleri hariç) tarafından alloster olarak bastırılarak, kanabinoidlere tepki verir gibi görünmektedir.
3.3 İyon Kanalları
İyon kanallarında CB1 reseptör aktivasyonunun etkileri ve nihayetinde nöronlardaki elektrik iletimi ve aksiyon potansiyeli öncelikle CB1’in PKA ve G proteinleri üzerindeki etkileriyle sağlanır. [91] Kobaylardaki bazı kanıtlar, CB1’in bazı iyon kanalları üzerindeki etkisinin cinsiyete bağlı farklılıklara maruz kalabileceğini düşündürmektedir. [107]
- PKA : Protein kinazlar, proteinlere fosfat grupları eklemek için kullanılır.
Spesifik olarak, CB1 reseptörleri, adenil siklazın bastırılması yoluyla cAMP’deki bir azalmaya ikincil olan A tipi potasyum kanallarını (KV1.4[108] ve KV4.2[91]) aktive edebilir, ve CB1’in aktivasyonunun, adenil siklazın Gi protein bastırmasına ikincil olarak L tipi kalsiyum kanallarını ve N tipi kalsiyum kanallarını da bastırdığınıda anlaşılmaktadır. [112] T-tipi kalsiyum kanalları CB1 aktivasyonu ile de bastırılmış gibi gözükmektedir. [113]
CB1 reseptörlerinin harekete geçirilmesi, nöronların ‘ateşleme’ (eylem potansiyelleri) frekansını ve dolayısıyla sinyallerini değiştiren iyon akışını değiştirerek nöronları etkiler. CB1 aktivasyonu potasyum kanallarının aktivasyonuna ve kalsiyum kanallarının bastırmasına neden olur ve nihai olarak ‘baskılayıcı’ veya ‘yatıştırıcı’ etkiye neden olur (GABA veya adenosin sinyaline benzerdir).
Geçici reseptör potansiyeli (TRP) adı verilen bir iyon kanalı ailesi, aktivasyon üzerine hücre zarını depolarize eder ve ağrı da dahil olmak üzere duyusal algılamada geniş bir rol oynamaktadır. [114] Kanabinoidlerin araştırılan kanabinoide bağlı olarak hem TRPA1 [115] hem de TRPV1 [116] aktivasyonu da dâhil olmak üzere TRP kanallarıyla etkileşime girdiği belirtilmiştir. Δ 9 THC, potansiyel olarak hücresel lokalizasyondan farklı olmasına rağmen, TRPA1’in etkidaşı olarak görülmektedir.
Hücre dışı TRPA1’in THC aktivasyonu, hücre içi TRPA1’e kıyasla, 700nM’lik bir Ki ile karşılaştırıldığında nispeten zayıf (20umM’den büyük Ki değeri). [117] Son 700nM afinitesi solunmasından sonra Kısa süreli olarak görülen seviyelere yakındır. [118] TRPV1, nöropatik ağrı ile ilişkili olduğu bilinmektedir, [119] Marijuana (Esrar) ağrı kesici etkileri için makul bir hedeftir.
Laboratuvar ortamındaki kanıtlar, kannabinol ve kannabidiol de dahil olmak üzere Marijuana’dan alınan birkaç kanabinoidin TRPV1 ve TRPA1’i desensitize edebildiğini ve muhtemelen ağrı yitimine neden olabileceğini düşündürmektedir.
Kanabinoidler, bazıları ağrı sinyalinde yer alan TRP kanalları adı verilen bir çeşit iyon kanalı ile etkileşime girer. Bazı Kanabinoidlerin, bu kanalları hücre modellerinde desensitize ettiği gösterilmiştir; bu, Marijuana (Esrar) maddesinin ağrıkesici yararlarını kannabinoid reseptörlerinin aktive edici etkilerinin ötesinde açıklayabilir.
3.4 15-LOX
Düşük yoğunluklu lipoprotein (LDL) ‘nin okside edilmesinde rol oynadığı ve damar tıkanıklığı gelişiminde önemli bir adım olduğu bilinen 15-lipoksijenaz enziminin, laboratuar ortamında 2.42μM’lik bir IC50 ile bastırdığı görülmektedir. [120] Bunun biyolojik açıdan uygun olup olmadığı belirsizdir, bununla birlikte aktif metabolit plazmada yalnızca 200 nM’ye kadar saptanma eğilimi gösterirken, THC’nin yaklaşık 1uM’lik konsantrasyona kadar dokularında standart kullanımla birikmesi bildirilmiştir. [120]
- IC50 :
Kannabinol ayrıca, metabolit Kannabinol -2 ‘, 6’-dimetil eter (CBDD) önemli ölçüde daha güçlü (2μM’de tam bastırma ve 280nM’de bir IC50) 15-LOX’i doğrudan bastırma kabiliyetine sahiptir. [121] [121] Diğer kanabidiol metaboliti kanabielsoin, bu konsantrasyonlarda tamamen inaktiftir. [120]
Yukarıda test edilen kanabinoidlerin hiçbiri, 15-LOX [120] üzerinde etkili oldukları aralıkta ve 15-LOX’e (3-LOX’e göre) CBDD seçiciliğinde, boswellia serrata‘nın moleküler hedefi olan 5-LOX’i bastırmamıştır ve 700’den büyüktür. [121]
Çok sayıda kanabinoid, iltihaplanma ve damar tıkanıklığında rol oynayan bir enzim olan 15-LOX’i bastırma özelliğini gösterirken, bu mekanizma Marijuana (Esrar) kullanımı konusunda belirsiz bir konumdadır.
4 Nöroloji
4.1 Adenosinerjik Sinir İletimi
CB1 kanabinoid reseptörü, adenil siklazı bastırmak için Gα i / o alt ailesinin G proteinleri aracılığıyla sinyal gönderen G proteini eşlenmiş reseptörüdür. [91] Bu yolla CB1 [122] ve adenosin A1 [123] reseptörleri çok ortak noktalara sahiptir; her ikisi de presinaptik olarak ve benzer beyin bölgelerinde bulunur ve burada glutamat salınımı üzerinde kollektif baskılayıcı etkiler yapar. [124]
[125] Ayrıca, CB1 ve A1, GABA B ile birlikte, ortak G protein havuzundan sinyal verirler. CB1 ve A1’in harekete geçirilmesi, katkı maddesinden daha düşük G proteini aktivasyonuna neden olurken, [126] A1 yolağının Kafein ile uyarılması CB1 yoluyla G proteinlerinin aktivasyonunu azaltır. [127]
Hem kanabinoid CB1 reseptörleri hem de adenosin A1 reseptörleri, kendi sinyalleme kademelerinde ortak ikinci haberciler açıkça paylaşırken, bunların karışımı tam olarak karmaşıktır ve tam olarak anlaşılamamıştır. Kanabinoidlere tolerans sırasında, A1 aracılı G protein aktivasyonu etkilenmezken, CB1’e bağlı aktivasyon baskılanır. [128] [129] Ayrıca A1 reseptörünün adenil siklaz bastırmasının kanabinoidlere karşı tolerans üzerine etkilenip etkilenmediği ile ilgili karışık bir kanıt vardır; yapılan bir çalışmada hiçbir etki bulamamıştır. [130]
Bir diğeri de A1 ve GABA B’nin uyarılmasından sonra bastırmasında bir azalma buluyor yaklaşık% 18’dir. [126] Beyin motor koordinasyonunu değerlendiren bir çalışmada A1 ve CB1 reseptörleri ile çapraz toleransa dikkat edildi. [131]
Tersine, Kafein (nöronlarda A1 reseptör yoğunluğunu arttıran tolerans) CB1 reseptör yoğunluğunu azaltır. [127][132] A1 reseptörlerinde eşzamanlı artış ve CB1 reseptörlerinde azalma, A1 aktivasyonunun CB1 presinaptik reseptörlerin aktivitesini laboratuvar ortamında bir analizde bastırdığı bir duruma yol açtı; burada A1’e bağımlı ortak Gα i / o havuzunun aktivasyonu, CB1 reseptörüdür. [127]
CB1 reseptörü (Δ9THC’nin psikoaktif hedefi) ve adenozin A1 reseptörü (kafein tarafından aktive edilir) beyindeki benzer bölgelerde bulunur ve adenil siklazı bastırmak için ortak ikincil haberciler (engelleyici G proteinleri) aracılığıyla sinyal verir. Bazı araştırmalara göre, bu, bu yolaklar arasında negatif çapraz-konuşma unsuru kazandırabilir.
4.2 Adrenerjik Sinir İletimi
Bir çalışmada, 30-70 mg’lık (yüksek dozda) Δ 9 THC’nin Kısa süreli oral alımının, idrar katekolaminleri etkileyebileceğini, noradrenalinin etkilenmediğini ancak iki saatlik işarette adrenalinin % 57 arttığını keşfetti (dört saat sonra temel). [133]
4.3 Agmatinerjik Sinir İletimi
Agmatine, kanabinoid sinyallemesi ile özellikle de CB1 reseptörü [135] [136] ve imidazolin reseptörleri [137] (agmatine’in etki edebileceği şekilde) etkileşimli görünen L-Arginin‘den türeyen bir sinir ileticisidir ve ve glutamat ile birlikte salınan bir ortak iletici olarak işlev görebilir.. [138]
Agmatin’in ağrıkesici özellikleri imidazolin reseptörlerine kısmen bağlıdır çünkü imidazolin ve CB1 reseptör bloke edicileri verildiğinde farelerin ısıdan kaynaklanan ağrıya tolere etme kabiliyeti azalır. [139] Agmatine ayrıca test kanabinoidlerinin ağrıkesiciliği sinerjik olarak arttırdığı (WIN 55212-2 ve CP55,940), agmatin’in kanabinoidlerin ağrıkesici özelliklerini arttırdığı görülüyor. [139] Agmatin’in kanabinoide bağlı hipotermiyi arttırdığı da kaydedildi. [140] [141]
Agmatinin, insanlarda test edilmek zorunda kalmasına rağmen, hayvan testinde ağrı ve hipotermik tepkileri sinerjik olarak artırdığı görünen beyindeki kanabinoid sinyaliyle ilişkili olduğu ileri sürülüyor.
4.4 Kanabidergik Sinir İletimi
Kannabinoid reseptörler CB1 ve CB2, başlıca psikoaktif bileşen olan Δ 9 THC, bu sınıf reseptörler için keşfedilen ilk potent ligand olduğundan bitki Esansiyel sativa bitkisinden alınıyor; O zamandan beri, araşidonik asit türevi anandamid gibi dahili kanabinoidler (endokannabinoidler) keşfedilmiştir. [142]
Bu reseptörler, CB1’in G1 / o [95] ile birleştirilmiş CB2 ve sadece G1 ile birleştirilmiş CB’siyle birlikte G proteine bağlıdır. [143] Bir reseptörün hücresel zar içine çekilmesi ve reseptörlerin reseptörünü hücrelere götüren harici bir hale getirilmesi, aktiviteyi düzenlemeye yardımcı olur. [144] [145]
Δ 9 THC, CB1’in kısmi bir etkidaşıdır ve ona bağlanmış G proteinini maksimuma aktive etmez. [143]
Kannabinol hem laboratuvar ortamında hem CB1 [146] [147] hem de CB2 [148] [147] reseptörlerinin ters etkidaşı olarak bilinir ve 1uM rimonabant ile karşılaştırılabilir bir potens ile 1uM’de CB2 üzerinde ters etkidaş olarak etkindir. [147] Bununla birlikte, daha düşük bir konsantrasyonda diğer etkidaşların bu reseptörlerin aktivasyonunu bloke edebildiği görülmektedir, ancak seçici olmayan etkidaş CP55940’ı 79nM’lik bir K B ile ve CB1 etkidaşı WIN55212’yi 138nM’lik bir K B ile bloke etmektedir.
Kannabinol’ün etkidaşlarını bloke etme kabiliyeti, ters etkidaş yeteneğinden yaklaşık 64.5 kat daha düşük bir konsantrasyonda görülmektedir. [147] Kannabinol , Δ 9 THC’nin etkilerini de engelleyebilir. [149]
Kannabinol , kanabinoid reseptörlerine bağlanan ligandların etkilerini bloke ettiği ve bu reseptörler üzerinde Δ 9 THC’nin etkileri ile negatif etkileşime girdiği göründü.
Marijuana (Esrar) subkronik maruziyetinin insanlardaki CB1 reseptörünü aşağıya çektiği bilinmektedir [150] ve farelerde üç gün maruz bırakıldıktan sonra Kısa süreli olarak bir azaltarak düzenlemesi kaydedilmiştir. [151] CB2 reseptörü durumunda, en azından sıçanlarda, esrar maruziyeti, bıraktıktan sonra CB2 reseptörü için serebral mRNA’da bir artışa neden olur. [152]
4.5 Kolinerjik Sinir İletimi
Δ 9 TNC, 168nM IC50’ye sahip rekabetçi olmayan bir inhibitör olmasına rağmen THC, α7-nikotinik asetilkolin reseptörlerini laboratuvar ortamında 1 uM’ye kadar konsantrasyonlarda etkilemektedir görünmemektedir. [153] Bu bastırma , laboratuvar ortamında alkol ile katkı maddesi olan anandamid [154] ile de görülebilir ve anandamid, aynı zamanda 1 uM’ye kadar konsantrasyonlarda Δ 9 THC’de görülemeyen α4β2 nikotinik reseptörlerini bastırır [156] Bu bastırma oluştuğunda CB1 reseptöründen veya CB2 reseptöründen bağımsız görünüyor. [156] [154]
Muskarinik asetilkolin reseptör seviyesinde, anandamid, M1 ve M4 reseptörlerinin zayıf (ve muhtemelen biyolojik olarak uygun olmayan) bastırmasını , 10-50uM arasında değişen bir IC50 değeriyle göstermiştir. [157] [158] [159]
Endokannabinoidlerin nikotin reseptörleri üzerinde inhibitör bir rol oynamasına rağmen, bu bastırma özelliği, Δ 9 THC ile tekrarlanacak gibi görünmemektedir, çünkü nikotinik asetilkolin reseptörleri ile etkileşime girmemektedir.
4.6 Dopaminerjik Sinir İletimi
Prefrontal korteksteki dopamin D2 reseptörleri, 5-HT 2A reseptörleri ile birleşerek heteromerler oluşturarak 5-HT 2A’nın etkilerini arttırma potansiyeline sahiptir. [160] [161] Bu heteromer oluşumu, bir haftalık tedaviden sonra farelerde kanabinoide ile tedavi edildikten sonra laboratuvar ortamında güçlendirilir. Bireysel 5-HT 2A , D 2 S ve D 2 L reseptörlerinin artmış membran lokalizasyonu da meydana gelir ve birlikte bu etkiler Marijuana (Esrar) alerjik bireylerde ruh hali ve bilişsel işlev bozukluğuna neden olan mekanizma ile ilişkili olabilir. [162]
Nöronlardaki kannabinoid sinyallemenin kronik altı bir süre boyunca (hafta) aktifleştirilmesinin, D2 dopamin reseptörlerini serotonin reseptör 5-HT 2A’nın yanında arttırdığı ve 5-HT 2A sinyalini güçlendiren birlikte bağlanma kabiliyetlerini teşvik ettiği belirtildi.
Kronik altı Kanabinoid maruz kalma üzerine 5-HT 2A ifadesinde artış, CB2 aktivasyonuna bağlı olarak ortaya çıkmaktadır, başka yerde [163] , D2 mRNA’nın bastırılması CB1 aktivasyonuna bağlıdır. [162] D2 mRNA’sının bu baskı altına alınması meni Marijuana (Esrar) kullanan annelerde rahim içinde bulundu. [164]
- mRNA : DNA’dan genetik bilgiyi gen ifadesinin protein ürünlerinin amino asit dizisini belirttikleri ribozoma taşıyan geniş bir RNA molekülü ailesidir.
Düşük D2 reseptörü içeriği ve ilacdan daha düşük dopamin salınımı, alkol, [165] amfetaminler [166] ve kokain gibi çeşitli uyuşturucu bağımlılığı durumlarıyla ilişkilendirilir. [167] Bununla birlikte, laboratuvar ortamında çalışmada azaltılmış D2 mRNA’yı belirtirken, kronik Marijuana (Esrar) kullanımı, kontrollere göre test edilen herhangi bir beyin bölgesinde dopamin D2 veya D3 reseptör kullanılabilirliği veya dopamin salınımı herhangi bir anormallik ile ilişkili görünmemektedir. [168] [169] [170] [171]
Belirli kanıtlara dayanarak, CB1 reseptörünün subkronik bir periyotta (hafta) aktivasyonu D2 reseptörünün transkripsiyonunu azaltabilir. Birleştirilmiş CB1 / CB2 etkidaşı (Δ 9 THC gibi) ile hücre zarı üzerindeki reseptör içeriğindeki bir artış ve dopamin sinyallemesinde bir artış ile birlikte ortaya çıkabilir. Marijuana (Esrar) kronik kullanımı ile birlikte görülen D2 reseptörünün azaltılmış bir ifadesi şu ana kadar gösterilememiştir.
4.7 GABAerjik Sinir İletimi
CB1 reseptörü, hipokampusta ve serebellumdaki GABAerjik internöronlarda, genellikle glutaminerjik nöronlardan daha büyük nispeten derecede eksprese edilir. [172] [173] Bu internöronlar (bu beyin bölgesindeki toplam nöronların yaklaşık% 10’u) hipokampustaki bazı CB1 eylemlerinin hedefi gibi gözükmektedir. [174] [175] Bu beyin bölgesinde, Δ 9 THC CB1 reseptörlerinin tam etkidaşı [176] olarak etki edebilir ve sonuç olarak CB1 uyarımı yoluyla GABA sinyalizasyonunu etkiler. [177]
CB1’in uyarılmasına ilaveten, bazı endokannabinoidlerin, pozitif allosterik düzenleyiciler (doğrudan GABAA’ya bağlandığı ve yalnızca reseptörü uyarmadığı, bağlanma üzerine GABA’nın etkilerini arttırdığı) olarak GABA A reseptörleri üzerinde etkili olduğu bilinmektedir. Δ 9 THC’nin de GABA A ile doğrudan etkileşime girdiği ancak zayıf bir şekilde etkileştiği bulundu. [178]
GABA iletiminin kendisine bakıldığında, kanabinoidlerle ilişkili hipokampal GABA aracılı iletimin bir bastırması var gibi görünüyor. [179] Spesifik olarak, CB1, eşzamanlılığı düzenler ve böylece GABA, değişik türdeki internöronlardan salınır. [177] Uzamış CB1 aktivasyonu CB1 reseptörlerinin içselleştirmesine ve toleransı azaltır; bu da bu bastırmasını hafifletir ve hücreleri nispeten doku ölümüne karşı daha hassas hale getirir. [180] Kanabinoide tolerans, Kanabinoidlerin epilepsi için muhtemel terapötik etkilerini de azaltabilir, çünkü yarar kısmen GABA aracılığı ile sağlanır. [181]
Δ 9 THC, GABA’yı CB1 reseptörlerine etki eden ikincil olarak bastırıcı bir şekilde etkiler; Δ 9 THC ve GABA A reseptörleri arasında da zayıf bir doğrudan etkileşim vardır. Kannabinoidlerin kronik kullanımı, bu yanıtı hafifletir gibi görünmektedir.
Farelerde Δ 9 THC’ye tolerans sırasında, GABA B aracılı G proteini aktivasyonu değişmiş gibi görünmemektedir. [129]
4.8 Glutaminerjik Sinir İletimi
Marijuana (Esrar) tüketiminin, büyük bir uyarıcı sinir iletimi olan glutamata etkisi, kısmen çalışma belleğindeki bozulmanın altında yatmaktadır. [182]
Çalışma belleği üzerindeki etki, çoğunlukla CB1 reseptörünün bu hücreler üzerindeki etkisinin ortadan kalkması nedeniyle Δ9THC’nin astrositler üzerindeki etkilerine dayanıyor gibi görünmektedir, (fakat glutamaterjik veya GABAerjik nöronlarda değil) bu da uzaysal bellek ve hipokampal sinapslar arasındaki sinaptik kuvvetin uzun süreli depresyonu (LTD) üzerindeki olumsuz etkilerini ortadan kaldırmaktadır.
Astrositler üzerindeki CB1 aktivasyonu, NMDA reseptörü (NR2B altbirimi) olarak bilinen nöronlarda glutamat reseptörünün belirli bir alt grubunu aktive eden ortam glutamatının serbest bırakılmasını arttırır. [183] NMDA reseptörlerinin bu şekilde etkinleştirilmesi, sinaptik LTD’ye ve çalışma belleğinde bozulmaya götüren AMPA reseptörü olan nöronlarda başka bir glutamat reseptör tipinin içselleştirilmesine yol açar. [183]
- AMPA : Nörotransmitter glutamatın etkilerini taklit ettiği AMPA reseptörü için spesifik bir etkidaş olan bir bileşiktir.
- NMDA : Sinaptik plastisiteyi ve hafıza fonksiyonunu kontrol etmek için NMDA reseptörü çok önemlidir.
Bağımsızca (kemirgenlerde 5-10 mg / kg THC damardan verilmesinin bir hafta), Δ 9 THC’nin NMDA reseptör ekspresyonunda (özellikle GluR1, NR2A ve NR2B altbirimleri ) [184] [185] aşağı düzenlenmesine neden olduğu görülmektedir. Azaltarak düzenleme doza ve zamana bağlıdır ve COX2’nin yukarı düzenlenmesi yoluyla aracılık edilir. [186]
Hem NMDA hem de AMPA reseptörü aktivasyonunun akış aşağı aktivasyonu hafıza oluşumu için çok önemli olan glutaminerjik hedef CREB, aktivasyonunu bazal seviyeye göre azaltmıştır ve sırayla azalmış NMDA reseptörü ekspresyonuna yol açabilir. [184]
Bu, laboratuvar ortamında kaydedilen ve subkronik Δ 9 THC uygulaması ile laboratuvar ortamında görülen ve hafıza zayıflığının altında yattığı düşünülen hipokampal plastisitenin azalmasına neden olur. [183] [184][188]
Δ 9 THC, glutamat sinyaliyle ilgili çalışma belleğindeki bozulmalara neden olur ve bu hem Kısa süreli hem de subkronik (haftalık) kullanıma kadar uzanırken, farklı yollardan aracılık edilir. Kısa süreli kullanım, genel olarak glutamatta bir artış ile birlikte azalmış AMPA reseptör kullanılabilirliğine ve daha düşük sinaptik plastisiteye yol açarken, subkronik kullanım için NMDA reseptörü içselleştirilir ve bu nedenle sinyal verme açısından aynı derecede mevcut değildir.
Astrositler üzerindeki etkilere ilaveten, CB1’in aktivasyonu aynı zamanda nöronları doğrudan etkileyebilir; hem ventral tegmental alan (VTA) [189] hem de hipokampal kesimde CB1 reseptörlerinin aktivasyonu presinaptik olarak nöronlardan glutamat salınmasını hafifletir gibi görünmektedir. Karışık kültürler (nöronların yanında astrositler gibi hem glial hücreler içeren), Δ 9 THC ile kuluçkalandığında, sinaptik glutamatta genel bir artış olur, presinaptik glutamatın bastırılmış salımı doğrudan pratik olarak uygun olmayabilir gibi görünüyor.[183]
Presinaptik CB1 reseptörlerinin aktive edilmesi glutamat salınmasını baskılamasına rağmen, astrositlerden glutamat salınımındaki artış daha büyük gibi görünür ve bu olası koruyucu etkiyi geçersiz kılar.
CB1 aynı zamanda HINT1 olarak bilinen bir protein ile bunlara bağlanarak ve birlikte içselleştirilmekte ve subkronik Δ9THC maruz kalması, NMDA’yı CB1 ile birlikte sitosol içine getiren CB1’i içselleştirerek hücre yüzeyindeki NMDA reseptörlerinin seviyelerini azaltabilmektedir. [194] [184]
Bu NMDA reseptörü aracılığıyla daha az glutaminerjik aktivite ile sonuçlanır. [193] [192] Rekabet eden NMDA etkidaşlarının CB1 aracılı ağrı yitimi [195] [193] engelleyebileceği ve çinko mobilizasyonunu (epilepsi ile ilgili), [193] her iki fonksiyonda da azaltabileceğinden, Δ 9 THC’nin eylemleriyle alakalı olduğu düşünülmektedir. Marijuana (Esrar) solunmasıyla ilgili olduğu bilinmektedir ve bağlanma proteini HINT1 içermeyen farelerde bu etki gözlenmemektedir. [193]
CB1’in NMDA ile birleşmesi sonuçta NMDA yoluyla sinyallemeyi azalttığı görülüyor. [191] [193]
CB1 ile bir ilişki nedeniyle NMDA sinyallemesindeki bu azalmanın, Marijuana’nın bazı koruyucu özelliklerinin altını çizdiği de düşünülmektedir, çünkü HINT1’den yoksun farelerin, kontrolsüz NMDA sinyallenmesi tarafından aracılık ettiği bilinen CB1 etkidaşları tarafından glutamatın neden olduğu nörotoksisiteden korunma söz konusu değildir.
CB1 ve NMDA fiziksel olarak birbirlerine bağlanabilir, bu da daha az NMDA sinyalizasyonuna neden olabilir. Bu mekanizma, NMDA reseptörü aracılığıyla azaltılmış glutamat sinyallemesinin uzun süreli bir bastırılmasına bağlı olduğu için epilepsinin ve nörodejenerasyonun azalması gibi Marijuana’nın olası faydalarının altında yatabilir.
4.9 Gliserinjik Sinir İletimi
Glisinerjik sinir iletimi (glisin ve D-serinin sinyal özelliklerine atfen) kanabinoidlerle etkileşime girdi gibi görünmektedir, [196] [197] Δ 9 THC doğrudan potensiyasyona sahip bir role sahiptir. [198] Glisin ile laboratuvar ortamında aktive edilen iyonik akımlar, alıcının yapısına bağlı olarak 73-115nM aralığında bir EC 50 değeri ile Δ 9 THC ile güçlendirilmiş gibi görünmektedir. [199]
Anandamid ile daha az güçlü olmasına rağmen, kanabinoidler üzerindeki hidroksil gruplarından glisin reseptörlerinin α1 altbirimine hidrojen bağlanması yoluyla reseptörü [199] direkt olarak oynak biçimde düzenlediği düşünülürse hem alkol hem de uçucu anesteziklerden (bunun yanı sıra glisinerjik sinir iletimini de güçlendirir) farklıdır. [200] [201]
Bu potensiyasyonun kısmen, psikoaktif etkileri olan ya da olmayan, Marijuana ağrıkesici özelliklerine katkıda bulunduğu kaydedildi, zira Marijuana (Esrar) etkileri bir glisin reseptörü (α3GlyR) bulunmayan farelerde azaltıldı. [200]
Gliserinerjik sinir iletim kanabinoidlerle güçlendirilmiş gibi görünüyor ve THC’nin kısmen ağrı kesici etkileri farelerde bu yol nedeniyle kısmen uyguladığı belirtiliyor.
4.10 Opioidergik Sinir İletimi
CB1 reseptörünün, hayvan kanıtlarının başlangıçta bir μ-opioid etkidaşı uygulamasının, kemirgenlerde ve primatlarda Δ 9THC’nin etkilerini arttırdığını belirttiği, opioid sinyallemeli çapraz karta katıldığı bilinmektedir ; μ-opioid sinyalinin bloke edilmesinin, kemirgenlerde ve primatlarda esrarın kendi kendine uygulanmasını azalttığı. [206]
Mekanik olarak, CB1 aktivasyonu ve μ-opioid reseptörleri A2a reseptörüne bağlı olarak sinerjistiktir; çünkü bu adenosin reseptörünün bloke edilmesi, ilaç arayan davranışa göre iki reseptör arasındaki sinerjiyi önler. [207]
Fakat μ-opioid sinyallemesinin engellenmesi Δ 9 THC veya diğer CB1 etkidaşlarından çekilmeyi hızlandırdığı belirtilmiştir [208], ancak benzer tasarımlar bu etkiyi primatlarda [209] veya ağır Marijuana içilen insanlarda bulamadı : [ 210] tür farklılıklarını önermektedir.
En azından hayvan kanıtlarına bakıldığında, opioid sinyal sistemi ve kanabinoid sinyal sistemi, ilacın kendi kendine yönetimi ve ödülü açısından birbirlerini olumlu bir şekilde etkilemektedir.
Ağır sigara içenlerde, Marijuana solunmasıyla birlikte naltrekson (opioid etkidaşı) uygulaması, algılanan yüksekliğin arttığı ve psikomotor işlevin bozulmasına neden olduğu belirtildi [211]
4.11 Serotonerjik Sinir İletimi
Δ9THC, genel olarak 5-HT3A reseptörleri (ağrı, uyuşturucu kullanımı ve kaygı ile ilgili bir serotonin reseptörü alt kümesi [214]) daha az olduğunda, oositlerde (olgunlaşmamış dişi gamet) laboratuar ortamında daha güçlü bastırıcı etkilerle serotoninin 5-HT3A reseptörleri üzerindeki etkilerini, 1.2 μM bir IC50 ile rekabetsiz bir şekilde engelleyebildiği görülüyor. (ve buna göre, reseptörler bol olduğunda daha az bastırıcı etkiler)
Endokannabinoid anandamid, bu reseptör üzerinde benzer önleyici etkilere sahiptir. [216] [217] Dahası, 5-HT3 ve CB1 reseptörleri, hipokampusun internöronlarında toplandı ve Δ 9 THC’nin, bu hücreleri, genel GABA sinir iletimini azaltmak için birden fazla yolla etkilediğini düşündürdü. [218]
Glisin ve serotonin reseptörlerinin, Δ 9 THC ile alloster olarak modifiye edilmiş olmasına rağmen, glisin reseptör etkileşimleri için gerekli olan hidrojen bağlanmasının 5-HT 3A reseptörlerine kadar uzanmadığı kaydedilmiştir. [201]
Bir serotonin alıcısı alt grubunun (5-HT 3A ) rekabet edilemeyen bastırması, endokannabinoidlerin yanısıra Δ 9 THC’nin düşük konsantrasyonlarında da belirtilmiştir.
Diğer reseptör alt grupları ile ilgili olarak, kanabinoid sinyalizasyonunun aktivasyonunun, hipotalamusun paraventriküler çekirdeğinde (PVN) [163] dahil olmak üzere muhtemelen aracılı olduğu 5-HT 2A reseptörlerinin bir yukarı düzenlenmesine neden olduğu kaydedilmiştir. [163] CB2 reseptörü aktive eden ERK1 / 2 sinyali, çünkü bu yukarı düzenlenmesi CB2’ye spesifik etkidaşlar [219] tarafından uyarıldı ve CB2 veya ERK1 / 2’nin selektif olarak sinyal vermesini engelledi. [220]
- ERK1/2 : Hücre büyümesi ve farklılaşmasının düzenlenmesinde kritik rol oynayan GMGC grubunun bir serin / treonin kinazıdır.
CB2 etkidaşlarına subkronik, ancak Kısa süreli olmaması, kemirgenlerde endişeye neden olduğu belirtilmektedir. [221] Bunun, GABA reseptörlerinin aşağı doğru düzenlenmesiyle (ve CB2 reseptörünü bloke ederek engellediği) [221] meydana geldiği ve kanabinoide bağlı kaygı artışının artmış 5-HT 2A reseptör yoğunluğuyla ilişkili olduğu başka bir yerde tekrarlandığı belirtilmektedir.
[163] Prolaktin ve kortikosteron üretimi (kısmen 5-HT 2A aktivasyonu ile artan) haftalık kanabinoid tedavisine yanıt olarak arttığı için, 5-HT 2A’nın eylemlerinin laboratuvar ortamında arttırıldığı düşünülmektedir. [163][222]
CB2 reseptörünün subkronik olarak (en az bir hafta) aktivasyonu, hipotalamik PVN’de 5-HT 2A reseptör yoğunluğunu arttırdığı ve daha sonra bu reseptör aracılığıyla sinyal gönderdiği kaydedildi.
Sentetik kanabinoid HU-120’nin subkronik (12 gün) uygulanmasının, yukarıda belirtilen 5-HT 2A reseptörünü yukarı düzenlerken ve etkidaşlarının hareketlerini arttırırken 5-HT 1A reseptör alt grubunun aktivitesini bastırdığı kaydedildi. [223] 5- HT1A etkidaşından kortikosteron salınımı, kanabinoidin ön tedavisi ile köreltilmiş gibi göründü. [223]
5-HT 2A reseptör aktivitesinde bir artış yanında, kanonibinoidlerin neden olduğu 5-HT 1A reseptör aktivitesinin kronik altı bir tarzda bastırılması da mümkündür.
4.12 Nörogenez
Laboratuvar ortamındaki farelere yedi gün boyunca Δ 9 THC verilmesi, nörojenezde rol oynayan beyin türevi nörotrofik faktörün (BDNF) mRNA ve protein içeriğini arttırdığı, bazı beyin bölgelerinde özellikle de [224] nükleer akumbens (NAc; protein içeriğinde 5.5 kat artış), ventral tegmental alan (VTA; 4 kat) ve paraventriküler çekirdeği (PVN; 1.7 kat) ve hipokampus üzerinde etkisi yoktu. [225] Bununla birlikte, bir başka fare çalışmasında, yüksek dozların aslında hipokampustaki BDNF düzeylerini yükselttiğini buldular. [226]
- BDNF : Kanonik sinir büyüme faktörü ile ilişkili olan nörotrofin büyüme faktörleri ailesinin bir üyesidir. Beyinde ve çevredeki nörotrofik faktörler bulunur.
THC, beyin türevi nörotrofik faktörün (BDNF) transkripsiyonunu arttırabilir, bu da nörojenezi desteklemeye yardımcı olur.
Endokanabinoidler, CB1 üzerinde etki ederek (ki bu da Δ 9 THC, aynı zamanda, ancak seçici olmasa da etkilenir), aşağıya doğru uzanan TrkB reseptörüne ve Src’ye bağımlı bir şekilde BDNF’nin yanındaki GABAerjik internöron göçünü ilave olarak artırdığı görülmektedir. [227]
- TrkB : Farklı hücre popülasyonlarının hayatta kalmasını ve farklılaşmasını uyaran küçük protein büyüme faktörleri olan birkaç “nörotrofin” için yüksek afiniteli katalitik reseptördür.
Bununla birlikte, interneuronların BDNF ile uyarılan morfogenezisi, CB1 aktivasyonunun varlığında, TrkB-Src sinyallemesine de bağımlı olarak bastırılmış gibi görünmektedir. [227]
CB1 reseptörlerinin aktivasyonu internöron göçü ve morfogenez üzerinde bazı etkilere sahip gibi gözükmektedir; pratik ilgisi bilinmiyor.
Δ 9 THC’nin katılımcılara enjeksiyonlarının, Marijuana (Esrar) kullanıcılarına (son bir ayda en az 10 kez kullanıldığı şekilde) serumda BDNF’nin daha düşük olduğu Marijuana (Esrar) toleransına dayalı serum BDNF üzerinde farklı etkileri olduğu belirtilmiştir. [228]
Kullanılmayanlar, daha yüksek bazal BDNF’ye sahip olmasının yanı sıra, enjeksiyonlardan 20 dakika sonra serum BDNF’sinde ciddi bir artış yaşamış, bir saat sonra normalize edilmiştir; Ancak Marijuana kullanıcıları böyle bir artış yaşamadılar. [228] Bu çalışmanın yazarları, BNDF serum düzeylerinin beyindeki seviyeleri yansıtmak için makul bir şansı olduğunu düşündürmektedir. [228]
Δ 9 THC’nin BDNF üzerindeki etkisi, geçmiş kullanımdan ötürü Marijuana (Esrar) toleransına tabidir. Marijuana (Esrar) kullanıcılarının, kontrollere kıyasla azaltılmış bir başlangıç BDNF’ye sahip oldukları ve Δ 9 THC’nin Kısa süreli IV uygulamasında kan düzeyi BDNF’de belirgin bir değişim göstermezken, sağlıklı kontrolün BDNF seviyeleri bunu yaptı. Beyin BNDF ölçülmezken, serum seviyeleri onlar için makul bir vekil olabilir ve beyinde meydana gelenleri yansıtabilir.
4.13 Sinir İltihaplanması
Glial hücreler, nöronal fonksiyonu destekleyen makrofaj benzeri beyin hücreleridir ve aşırı aktifleştirildiklerinde nörodejeneratif bozukluklara oldukça karışırlar. [229] [230] Δ 9 THC, bu hücrelerdeki iltihaplanmayı CB2 reseptörleri üzerine etkisiyle bastırabilir [231] ve CB2 reseptörlerini aktive etmeyen Kannabinol olmasına rağmen, lipopolisakkarid için iltihaplı genomik yanıtı bastırdığı görülmektedir. [232]
- LPS : Bir lipit ve bir kovalent bağ ile birleştirilen O-antijen, dış çekirdek ve iç çekirdekten oluşan bir polisakaritten oluşan büyük moleküllerdir; Gram-negatif bakterilerin dış zarında bulunurlar.
- IL-1β : Nörotoksik sinir iletimini modüle eden ve glutamaterjik nörotransmisyonu artırarak nöbetleri uzatan pro-iltihaplı bir protein ve peptittir.
- PPARγ : Makrofajların bir alt kümesinde de eksprese edilir ve doğal ve sinerji ligandlarına yanıt olarak birçok iltihaplanma gen ekspresyonunu negatif olarak düzenler.
LPS, bir iltihaplı uyaran ve 10uM’de IL-1β’nın ekspresyonunu% 81 düşürdüğü kaydedildi. [232] Kanabibidolün mekanizması, PPARγ’ya ikincil olabilir, çünkü bu nükleer reseptörü, kanabinoid reseptörleri ile ilgili olmayan glial hücreler üzerinde anti-iltihaplanma etkiler yapmak için harekete geçtiği belirtilmiştir. [233] [234]
Kanabinoidler beyindeki iltihaplanmayı keskin bir şekilde bastırmakta ve Δ 9 THC ve Kannabinol , farklı mekanizmalara rağmen aktif gibi görünmektedir.
4.14 Baş Ağrısı ve Kan Akışı
Sırtüstü bir pozisyondan ayakta durma pozisyonuna ulaşıldığında ortostatik hipotansiyon / baş dönmesi, transkraniyal Doppler önlemleri ile değerlendirildiği gibi, azalmış serebral kan hızı ile ilişkili olduğu düşünülen sağlıklı insanlarda damariçi Δ9THC uygulanmıştır. [239] Bu ortostatik hipotansiyon ödem ile birlikte kaydedilen ve kan hacmindeki karşı düzenleyici bir artışla ilişkili olduğu düşünülen, kronik Δ 9 THC uygulamasına toleransa tabii tutulmuştur. [235]
Marijuana (Esrar) için marjinal kullanıcılar, ayakta kaldıkça ortostatik hipotansiyona maruz kalabilir ve bu ortostatik hipotansiyon, Marijuana (Esrar) toleranslı olanlarda azalır.
Orta serebral kan hızındaki azalma, 10 dakika sonra Marijuana ile ilişkili ortostatik hipotansiyon örneklerinde ve plazma THC içeriği ile ilişkili olmadığında görülür. [238][239]
Beynin yarım küresine bakıldığında, hem yarımkürede ve küresel olarak doza bağımlı olan, 30-120 dakika (artık iki saat işaretinde artık mevcut değil) arasındaki plasebo solunmasına göre serebral kan akışında bir artış olduğu görülmektedir. [1] [240] Serebral kan akışındaki bu artış CB1 reseptörleri [241] [242] tarafından yönlendirilir (CB1 reseptörleri bazal koşullar altında kan akımının düzenlenmesinde son derecede yer almamasına rağmen).[241]
Damariçi Δ9THC ile pozitron emisyon tomografisine maruz kalan insanlarda kan akışındaki artış, özellikle ön lobları, sağ yarımküreyi ve özellikle de ön cingulate korteksi destekliyor (kalp atış hızı gibi kardiyovasküler fonksiyonlarda oldukça rol oynar) [243]
Esrarın solunmasından kısa bir süre sonra ortostatik hipotansiyon, söz konusu ortostatik hipotansiyonun nedeni olduğu düşünülen kan akış hızındaki azalmaya karşılık gelirken, 30 dakika veya daha uzun bir süre sonra, beyine genel kan akışında bir artış olduğu görülmektedir.
4.15 Ağrı Yitimi
Klinik öncesi araştırmalar, CB1 reseptörünün ağrıyı algılama ve yanıt verme (nosisepsiyon) için önemli olan beyin bölgelerinde ifade edildiğini, [244] [245] [246] , kannabinoid sinirlerinin nosiseptif iletimde önemli bir rol oynayabileceğini düşündürmektedir. [247] Marijuana (Esrar) solunması ağrıyı hafifletir gibi gözükmekte, ancak bu, ayrışma ile ilgili bir etkidir ve algılanan yoğunluktan ziyade bildirilen ağrı hoşnutsuzluğunu azaltır. [248]
CB1 aktivasyonunun ağrı çözülüm üzerindeki etkisi, önce Marijuana (Esrar) kullanmamış olanların [248] ve solunmasının 45 dakika içinde hızlı bir şekilde başlamış olanlarda ortaya çıkabilir. [247] CB1 etkidaşlarının hiperaljezik hallerde özellikle etkili olduğu tespit edildiğinden, etkinlik algılanan ağrı şiddeti ile de bağlantılı olabilir. [247] [249] İlginç bir şekilde, Marijuana (Esrar) ağrısında iki fazlı bir etkiye sahip olduğu gösterilmiştir; orta dozlar en sağlam ağrıyı hafifletir ve yüksek dozlar aslında ağrı arttırır. [247]
Bu fikirle uyumlu olarak, 20mg Δ 9 THC’nin aktif bir dozunu kullanan en az bir çalışma, oral kapsül alımından 2.5 saat sonra herhangi bir ağrı giderme etkisi bulamadı; bunun yerine ağrıya karşı duyarlılığın arttığına dair bir bulgu bulamadı. [250]
Kapsül veya inhaler olarak uygulandığında Δ 9 THC’nin Kısa süreli bir ağrıkesici etkisi var gibi gözükmektedir. Bu, en çok nöropatik ağrı için kapsaisin modelinde test edilmiştir. Özellikle, bir çalışma, Marijuana (Esrar) ağrısı üzerinde iki fazlı bir etkiye sahip olduğunu belirtti; orta dozlar ağrı gidermeye ve daha yüksek dozlarda ağrı algılamasına neden oluyor.
Ağrının topikal kapsaisin tarafından uyardığı, aksi halde sağlıklı gönüllülerde görülen ağrının ayrılması doğru amigdal aktivitesi ile ilişkili gibi görünmektedir; [248] öncelikle çok belirgin uyaranları işleyen bir beyin bölgesi [251] ve ağrı algılamasında yer aldığı bilinmektedir. [252] [253] Bazı periferik mekanizmaların CB1 aktivasyonundan gözlenen ağrıkesici etkilere katkıda bulunabileceğinden, ağrıkesici etkileri kısmen açıkladığı düşünülmektedir. [254]
Marijuana (Esrar) ağrısının hafifletilmesine etkileri beyindeki amigdala bölgedeki CB1 aktivasyonunun aracılık ettiği görülmektedir.
Marijuana (Esrar), nöropatik ağrının tedavisinde test edilmiştir ve plaseboya kıyasla (% 0 THC içeriği) füme olduğu zaman ağrıyı azaltmada etkili olduğu bulunmuştur. [255] [256] Buharlaşmış Marijuana (Esrar) aynı zamanda nöropatik ağrıya sahip geleneksel tedavilere dirençli hastalarda da dahil olmak üzere, ağrıyı plaseboya göre azaltmada etkili olduğu bulunmuştur. [257]
Sigara içen Marijuana (Esrar) ayrıca nöropatik ağrı için diğer tedavilere benzer fayda sağlayan plasebo kontrollü çalışmalarda HIV ile ilişkili nöropatik ağrıda etkili olduğu ve ağrıyı yönetmek için diğer tedavilerin üzerine eklendiğinde ek rahatlama sağladığı bulundu. [257][258] [259]
Buharlaşmış ve tütsülendirilmiş Marijuana (Esrar) fiziksel travma ve HIV dahil olmak üzere çeşitli nedenlerden kaynaklanan nöropatik ağrıyı azaltmada etkili görünüyor.
4.16 İştah ve Yemek Alım Miktarı
Marijuana, eğlence kullanıcılarında ‘yeme isteğinin’ ana nedenlerinden olan açlığı artırdığı iyi bilinmektedir. Marijuana (Esrar) maddesinin artan etkileri, HIV, kanser veya kas tüketimiyle ilişkili diğer hastalıklarla (kaşeksi) birlikte iştahı artırmak için tıbbi kullanımını da buldu. [260] Marijuana’nın iştahı uyarıcı etkileri, CB1 reseptörünün Δ 9 THC aktivasyonu tarafından yönlendirilir ve açlığın arttırılması için karın ve bağırsaklardan salınan bir peptit hormonu olan ghrelin ile iç içe geçmiş durumdadır. [261]
Ghrelin sonuçta hipotalamustaki sinyal yoluyla gıda alımını artırır, kısmen artan hipotalamik AMPK aktivitesi, besin algılamanın merkezi bir kontrol noktasıdır. [262] [263] Bu eylem CB1 reseptörüne [264] ve ghreline (GHS-R1a) reseptörüne bağlıdır, ancak aynı şey Δ 9 THC gibi kanabinoidler için de geçerlidir. [265] Ghrelin endokannabinoid 2- arachidonoylglycerol sentezini artırabilir, [264] AMPK, ghrelin ve iştah ve enerji dengeleşiminin kontrolü için endokannabinoid sistem arasında çok sayıda karışma olduğunu düşündürmektedir.[265]
İlginç bir şekilde, ghrelin iştahını tetikleyen etkiler için CB1 aktivasyonunun gerekliliği, beyne ulaşamayan CB1 reseptör etkidaşları , merkezi olarak uygulanan ghrelin’in iştah artışı etkilerini bloke etmekte hala oldukça etkili olduğu gibi, merkezi sinir sisteminden ziyade periferde meydana gelebilir. [266] Bu nedenle, vücut üzerinde hareket eden CB1 etkidaşları , merkezi olarak etki eden CB1 etkidaşları ile ilişkili olma eğiliminde kaygı uyandırıcı etkilerin olmaması nedeniyle antiobezite maddesi olarak şu anda test edilmektedir. [267] [268]
Marijuana (Esrar) ve diğer kanabinoidlerin iştah artan özellikleri, “bağırsak-beyin” açlık hormonu ghrelin’in serbest bırakılmasının yanı sıra CB1 reseptör aktivasyonu yoluyla ortaya çıkar.
Ghrelin düzeylerini arttırmanın yanı sıra, HIV hastalarında [269] Marijuana (Esrar) solunmasının (kör) iştahı baskılayıcı peptit PYY seviyelerini düşürdüğü kaydedildi. [269]
Marijuana (Esrar) içen insanlarda serum ghrelinde bir artış ve iştah baskılayan peptid PYY’nin azaldığı görülmüştür.
4.17 Dikkat ve Odaklanma
800 mg Marijuana (Esrar) (% 5.5 veya% 6.3 Δ 9 THC) içeren sigara verilen ağır Marijuana (Esrar) kullananlarda (her hafta ortalama 5.4 +/- 1 eklemle altı seansta) ve daha sonra bilgisayar ekranında bir öğeyi bilgisayar ekranında takip etmeyi içeren bir dikkat testi verildi 10 dakika, Marijuana (Esrar) plasebo teneffüsüne göre dikkati kötüleştiremedi. [270]
Kronik Marijuana (Esrar) kullanımı, insanlarda (PET görüntüleme) ilişkili bulunan, kronik Marijuana (Esrar) kullanımı ile birlikte görülen dopamin sentezinde bir azalmaya neden olan motivasyonda (yani apati) bir azalma ile ilişkilendirilmiştir. [271]
Kronik Marijuana (Esrar) kullanımında görülen motivasyonda bir azalma, dopamin sentezinde bir azalmayla bağlantılı olabilir.
Ağır Marijuana (Esrar) kullananlarda (en az 2 yıl boyunca haftada en az 4 kez tüketilen) randomize bir çalışma, orta doz THC (5.5 mg Δ 9 THC ile) ile Kısa süreli Marijuana kullanımının yaratıcılığın ölçümleri üzerinde herhangi bir etkisi olmadığını buldu (özellikle, yakınsak ve farklı düşünme önlemleri). Bununla birlikte, deneycilerin beklentilerinin aksine, Δ 9 THC’nin (22 mg) daha yüksek dozlarıyla Kısa süreli Marijuana , birbirine yakın düşünmeyi etkilemeden farklı düşünmeyi bozmuştur. [272]
Ağır Marijuana (Esrar) kullananlardaki bir çalışma, orta dozda Δ 9 THC ile yapılan Marijuana (Esrar) kullanımının iki ölçüt etkilemediğini, buna karşılık yüksek dozların yaratıcılığın bir ölçüsü daha da kötüleştiğini (farklı düşünce) buldu.
4.18 Sedasyon ve Uyku
Kannabinoidlerin (Marijuana (Esrar) kullanımı da dâhil olmak üzere) etkilerinin sistematik bir şekilde gözden geçirilmesi kısa bir süre önce tamamlanmış ve çoğu çalışma, kısa vadede, yüksek önyargı riski ile karışık sonuçlar ve genel çalışma kalitesinin zayıf olduğu ve ağırlıklı olarak sadece Kuzey Amerika’daki küçük ve sınırlı nüfuslarda yapılmıştır. [273] Yazarların temel sonuçları, Marijuana’nın yavaş dalga uykusunu (hafıza konsolidasyonunda rol oynayan derin uyku) [274] azalma eğilimi göstermesi, aksi tutarsız etkiler ve toplam uyku süresi üzerinde çok az etkisi olduğu yönündedir. [273]
Ayrıca, sadece tıbbi olarak kullanıldığı durumlarda, uyku üzerindeki faydalı etkilerinin, bazı hastalık durumlarının uyku rahatsız edici semptomlarını azaltma kabiliyetinden kaynaklanabileceği durumlarda, uyku kalitesi üzerinde de olumlu bir etkisi olabilir. [273]
Literatürdeki ikinci bir gözden geçirme, bazı yönlerde, çoğu çalışmada azalmış yavaş dalga uykusu gösterdiğini ve yavaş dalga uykusunda Kısa süreli artışların görüldüğünü ve daha fazla kronik kullanımla azalmanın meydana geldiğini belirtti. [275] Çoğu araştırmanın REM uykusunda azalma gösterdiğini iddia ederek sistematik gözden geçirme [273] ile doğrudan ters düşen, çok karışık sonuçlar verdi. [275]
- REM : Gece boyunca meydana gelen ve hızlı göz hareketleri, daha çok rüya ve bedensel hareket, daha hızlı nabız ve nefes alma ile karakterize olan bir tür uykudur.
Daha kaliteli ve daha yeni çalışmalardan birinde, sağlıklı gönüllülere, Δ 9 THC ve Kannabinol , tek başına 15 mg Δ 9 THC veya plasebo ile birlikte 5 mg veya 15 mg’lık bir çapraz deneme içeren bir burun spreyi uygulandı. [276] Gece kombinasyon spreyini kullandıktan sonra 3. evde uykuda (yavaş dalga aşamalardan birinde) bir azalma ve kombinasyon dozu arttıkça uyanıklıkta bir artış görüldü. [276]
15 mg’lık Δ 9 THC tek başına uyku süresi etkisi göstermezken, sprey uygulamayı takip eden günde, sabah uyku gecikmesi plaseboya kıyasla azaldı. [276] Bu, 15 mg Δ 9 THC / Kannabinol grubunda gece boyunca uyanıklık süresinin artması ile birlikte, Δ 9 THC’nin biraz sakinleşebileceğini ve Kannabinol uykuda uyanıklığı artırabileceğini düşündürmektedir. [276]
Marijuana (Esrar) ve bileşenlerin etkileri üzerine çeşitli çalışmalar yapılmış olmakla birlikte, çalışmalar küçük ve kontrolsüz olma eğilimindedir ve karışık sonuçlar verir. Daha tutarlı sonuçlardan biri, uzun süreli bellek konsolidasyonunda önemli olan derin uykudaki bir Kısa süreli azalmadır.
4.19 Epilepsi ve Konvülsiyonlar
Endokannabinoidlerin nöbetler meydana geldiğinde nöronlardan salındığı ve CB1 reseptörlerini harekete geçirerek nöbet sıklığını ve süresini kontrol ettiği için epilepside koruyucu bir etkisi olduğu düşünülmektedir. [278] [279] Bu fikirle uyumlu olarak, CB1 reseptörünün bloke edilmesi, laboratuvar ortamında modellerde nöbetlerin şiddetini arttırabilir ve CB1 reseptörlerinin azalması, laboratuvar ortamında uzamış kanabinoid maruziyeti ile de daha az tonik bastırmasına neden olur [180] ve anti-epilepsi aktivitesinde azalma görülmüştür. [181][277] [280]
CB1 reseptör aktivasyonunun anti-epileptik aktivitesinin, CB1 ve NMDA reseptörü arasında, glutamat sinyallemesini baskılamak üzere işlev gören bir heterodimer oluşması yoluyla oluştuğu düşünülmektedir. [279] [193]
Aşırı glutamat sinyali, daha sonra kalsiyum akışını ve peroksinrat oluşturmak üzere okside hale gelen hücre içi Nitrik Oksit (artmış nNOS aktivitesi yoluyla) üretimini arttıran NMDA’yı aktive ederek nöbetleri teşvik eder. Nöronlarda daha sonra peroksinrat ile uyarılan Çinko salınımı, glutamattan uyarıcı sinyali artırarak, disregüle nöronal ateşlemeye neden olur. [281] [282]
Nöronlardaki CB1 aktivasyonu, NMDA reseptörünün başlangıçta aktivasyonunu bloke ederek glutamat sinyalini baskılamaktadır. [193] [283] Glutamat sinyalizasyonunun kontrolü oldukça karmaşık olsa da, CB1 aşırı NMDA sinyalini en iyi şekilde engelleyen dahili regülatör olarak düşünülür. [192] [185]
THC’nin anti-epileptik etkileri, nöbetleri azaltmak için uyarıcı glutamat sinyalini bastıran CB1 reseptörünün aktivasyonu yoluyla oluşur. Bu mekanizma laboratuvar ortamında toleransa maruz kalmış gibi görünse de, şu an bu fenomenin laboratuvar ortamında oluşup oluşmadığı bilinmemektedir ve bu nedenle en azından Δ 9 THC pratik bir epileptik ilaç olarak görülmemektedir.
Kannabinol (CBD) esrarda öncelikle epilepsi için araştırılan psikoaktif olmayan biyoaktif bir maddedir. CB1 reseptörüne etki etmek yerine, laboratuvar ortamında olarak TRPV1 kalsiyum kanalı üzerinde etki ettiği ve bu kanalı hızla duyarsızlaştırdığı ve hiper-uyarım için daha az potansiyel oluşturduğu düşünülmektedir. [284] Bu özellik, TRPV1 3.6μM üzerinde EC 50 (420nM’de EC 50 TRPA1 ve TRPV2 7.3μM) ile propil analoğu kannabidiverin (CBDV) için de geçerlidir ve TRPA1’de de benzer bir işlev var gibi gözüküyor. [285] [286]
Kemirgenlerde, bu kanabinoidlerin, Δ 9 THC, [289] [290] gibi CB1 aktivasyonuna bağlı olmayan bir şekilde anti-epileptik etkiler [287] [289] [289] [290] uyguladığı bilinmektedir ve sodyum kanallarını bloke etmek için bitki kanabinoidleri, kemiricilerde epilepsiye terapötik yararların temelini oluşturamayabilir. [291]
TRP kanallarındaki işlemlerin terapötik yararlar altına düştüğü düşünülmektedir. Dahası, Kannabinol toleransın uzun süreli kullanımda göze çarpan bir özellik olduğu bilinmediğinden (muhtemelen hızlı toleransa maruz kalan Δ 9 THC’nin aksine), potansiyel bir terapötik molekül olduğu öne sürülmüştür. [292]
Esrar ürünlerinin çocukluk çağı epilepsisinde kullanımını değerlendiren araştırmalarda, küçük bir örneklemde, ebeveynlerin% 84’ünün kannabidiol bakımından zengin ürünlerle semptomlara faydalarının, sadece yarısının altında semptomlarda en az% 80’lik bir azalma bildirdiği bildirildiği bildirilmiştir ; [293] Bu anket, kullanılan ürünlerin Kannabinol içeriğinde çok çeşitli olduğunu belirtti.
Marijuana (Esrar), Kannabinol ve kanabidiverin (CBDV) psikoaktif olmayan iki bileşeni, TRPV1 olarak bilinen kalsiyum kanalını halen hızla duyarsızlaştırmayı aktive ediyor gibi görünmektedir. Bu duyarsızlaştırma, nöronun hiper uyandırılabilir hale gelme olasılığının azalmasına ve epilepsi tedavisinde kronik Marijuana (Esrar) kullanımının yararlarının altında yattığı düşünülmektedir. İnsan çalışmaları eksik olsa da, bir anket güçlü terapötik etkileri öne sürüyor.
4.20 Kaygı ve Stres
Çok sayıda kohort çalışmasının bir meta-analizi, genel popülasyondaki Marijuana kullanımı veya Marijuana kullanım bozuklukları ile sürekli / durumluk anksiyete, anksiyete bozuklukları, panik bozuklukları ve travma sonrası stres bozukluğu (TSSB) ve çeşitli anksiyete durumları arasındaki ilişkiyi değerlendirmiştir ; ve obsesif kompulsif bozukluk sırasındaki anksiyete gibi diğer zihinsel bozukluklarla birlikte ortaya çıkan diğer endişe teşhisi tipleridir.
Uzun süreli Marijuana (Esrar) kullanımı ile genel olarak pozitif bir ilişki olduğu görüldü, ancak büyüklük açısından nispeten küçüktür. Anksiyete ve esrar kullanımı arasındaki ilişkilerde, olasılık oranı 1,24, (% 95 güven aralığı (CI): 1,06-1,45), anksiyete ve esrar kullanım bozuklukları olasılık oranı 1,68 (% 95 CI: 1,23-2,31) ve kombine kaygı ve depresyon ile Marijuana kullanımı 1.68 olasılık oranı (% 95 CI: 1.17-2.40) idi. [294]
Genel popülasyonda Marijuana (Esrar) kullanımı, anksiyete ile pozitif ilişkilidir.
Esrar kullanımı ile kaygı arasında zamansal bir ilişki kurmak için sadece beş çalışma olsa da, esrar kullanan insanların, esrar kullanmayan kullanıcılara kıyasla, (olasılık oranı 1.28; 95% güven aralığı : 1.06-1.54). yaşamın ilerleyen zamanlarında kaygı geliştirme riskinin arttığı görülüyor.
Çalışması aynı zamanda daha yüksek dozlarda ve marijuana kullanım süreleri çıkarmış, ancak her çalışmada daha koruyucu olasılık oranı kullanmış ve esrarla birlikte alınan (tütün ürünleri yoluyla nikotin gibi) bazı ilaçlar da anksiyete belirtileri için uzun vadeli riski artırabileceğinden, mümkün olduğunda karışıklıklar için kontrol edilmiştir. [323]
Marijuana (Esrar), sürekli kullanımın uzun yıllar boyunca anksiyete ve panik semptomları (bir bozukluğun teşhisi konabilen derece kadar) gelişme riski ile ilişkili görünmektedir. Uzun vadeli kullanım riskinin artması nispeten daha düşük, genellikle 2.00 oranının (çift risk anlamına gelmektedir) aşılması gibi görünmemektedir.
4.21 Depresyon
Yoğun ergen ve erişkin Marijuana (Esrar) kullananlarda (yaklaşık günlük kullanımda) sigara içmeyenlere kıyasla yaşamın ilerleyen dönemlerinde depresyon için artmış bir risk olduğu görülmemektedir. [304] [324] Zaman zaman Marijuana (Esrar) kullanımı ile depresif belirtiler arasında pozitif bir ilişki kaydedilmesine rağmen [325] [326] kaygının aksine, bazı çalışmalarda karıştırıcı faktörleri kontrol ettikten sonra elimine edilmiştir. [327] [328]
Dahası, kasıtlı olarak ciddi marijuana kullanıcılarını ciddi bir depresyon ile ararken, esrar kullanımının esrar kullanmayanlara göre daha az depresif belirtilerle ilişkili olduğu görülmüştür. [329] Bununla birlikte, araştırmaya giriş üzerine başlangıçtaki depresyonu kontrol eden tamamen ileriye dönük araştırmaların bir meta-analizi, Marijuana (Esrar) kullanımının depresif belirtilerle ilişkili olur.
Olasılık oranının 1.17 (% 95 güven aralığı 1.05-1.30 ) ve kullanıcılar veya hafif kullanıcılar ile karşılaştırıldığında olasılık oranı 1.62 (% 95 güven aralığı 1.21-2.16) ile ağır kullanıcılar arasında daha güçlü bir ilişki; Kullanıcıların yaşı ile hiçbir ilişki görülmedi ve çalışmalar arasında yüksek bir heterojenite vardır. [330]
Marijuana (Esrar) kullanan kişilerde kombine depresyon ve anksiyete teşhisi için hafifçe artmış risk başka bir meta-analizde (1.68 ve % 95 güven aralığı 1.17-2.40 arasında OR) kaydedildi. [294] Önemli olan, kombine depresyon ve kaygı, yalnızca depresyondan ayıran bir tanıdır.
Marijuana (Esrar) kullanımına ilişkin kanıtlar ve depresif belirtilerin gelişimi karışıktır. Bazı araştırmalar, uzun süreli Marijuana (Esrar) kullanımının, kullanmayanlara kıyasla depresif belirtilerin gelişimi için artmış uzun vadeli risk ile ilişkili görünmediğini göstermektedir. Bununla birlikte, bazı olumlu ilişkiler kaydedildi ancak depresyonun gelişimine katkıda bulunan Marijuana (Esrar) kullanan (sosyal statü veya diğer ilaç kullanımı gibi) insanlarda sıklıkla karıştırıcı faktörler mevcut ve konunun meta-analizleri genellikle yüksek heterojenite buluyor, ve genellemeleri biraz zorlaştırıyordu.
4.22 Hafıza ve Öğrenme
Marijuana hafıza ve öğrenmenin etkileri, kısa, orta ve uzun vadeli etkilere bölünebilir. Kısa sürede (içilen saatler içinde) Marijuana (Esrar) sürekli olarak çalışma ve kısa süreli hafızayı etkilediği gösterilmiştir. [331] [332] Orta vadede, (haftalarca yoksun kalıp gündenlerden sonra) çalışma hafızası üzerinde kalıcı bir etki bulunamamasına rağmen, karar verme üzerinde kalıcı bir etki gözlenmiş olsa da, içmenin kendi kendine bildirme sıklığı ile ilişkili olduğu görülmektedir. [333] [334]
Çekimser olan Marijuana (Esrar) kullanıcılarında, en az bir ikiz çalışma, biliş için uzun süreli bir bozukluk (Orta vadede 20 yıllık Marijuana (Esrar) kesilmesi ile) bulamadı; [335] başka bir çalışmada, uzun süren esrar kullanıcıları ve diğer maddelerin kullanıcıları arasında bir fark bulunmadığı ve kısa süreli çalışmaları değerlendiren bir meta-analiz, olası bozulmaların, bundan daha uzun süreler için herhangi bir değer bulamadığı için 25 gün ile sınırlı olduğunu göstermiştir. [337]
Esrardan bir ay süreyle uzak durulduğunda, ağır kullanıcılar (haftada 94 +/- 15 füme) temel çalışma hafızasına ve bilişine geri dönerken, orta (haftada 42 +/- 18 füme ) ve hafif (11 +/- 4 eklem) bir hafta) kullanıcılar tamamen normalleşiyor gibi görünüyor. [333]
Esrarın kısa süreli olmayan etkilerine ilişkin başka bir meta-analitik çalışma, öğrenme ve affetme üzerinde küçük ama önemli etkiler buldu, ancak birkaç uyarıya dikkat çekti: Birincisi, çoğu çalışmada kullanılan popülasyon genç, sağlıklı ve daha iyi eğitimliydi; diğer topluluklara genellenebilir olmayabilir ; İkincisi, bu konuyu incelemek için kaliteli yapılan birkaç çalışma vardır.
Marijuana (Esrar) birçok farkındalık parametresini etkileyebilirken, olumsuz bir şekilde en çok etkilenen alanlardan birisi, dikkat / çalışma belleği alanını, [340] , unutulmada artış ve motor kontrolünde azalma ile ortaktır. [340] Ağır koşullar altında Marijuana (Esrar) verildiği ağır kullanıcılar üzerinde yapılan çalışmalarda, solunmasının, sözcük geri hatırlama işlemini bir rakam geri çağırma görevi olarak değerlendirildiğinde bozduğu belirtildi. [270]
Marijuana (Esrar), içtikten sonraki haftalarda bellek, dikkat ve motor kontrolü bozar ve içtikten sonraki günlerde küçük etkilere sahip olabilir. Bununla birlikte, şimdiye kadarki en iyi kanıt bellekte uzun vadeli bir etkisi olmadığını göstermektedir.
Marijuana (Esrar) maddesinin hafıza zayıflama etkileri Δ 9 THC içeriğine atfedilir, çünkü saf kannabinoidin araştırma hayvanlarının çalışma belleğini bastırdığı gösterilmiştir. [341] Δ 9 THC’nin uyardığı bellek bozukluğu, araşidonik asidi beyindeki prostanoidlere dönüştüren bir enzim olan CB1 aracılı siklooksijenaz-2’nin (COX-2) uyarımı yoluyla oluşur. CB1’in aşağı akışındaki Cox-2 uyarımının, CB1 reseptörünün veya COX-2’nin bastırılması, CB1 aktivasyonunun, hafıza bozukluğu üzerindeki etkilerini sınırlayabildiğinden, Δ 9THC tarafından hafıza kaybı için gerekli görünmektedir.
- COX-2 : Artrit rahatsızlıklarının, adet kramplarının ve spor yaralanmaları gibi akut yaralanmaların acılarını tedavi etmek için kullanılan reçeteli ilaçlardır.
- CREB : Hücresel bir transkripsiyon faktörüdür. CAMP yanıt elementleri (CRE) olarak adlandırılan belirli DNA dizilerine bağlanır, böylece genlerin dna’dan rna’ya dönüşümü artar veya azalır.
- Sinaptik plastisite : Sinirbilimde sinaptik plastisite, sinapsların aktivitelerindeki artış veya azalmaya yanıt olarak zaman içinde güçlendirme veya zayıflama yeteneğidir.
Δ 9 THC’nin kronik kullanımı da sinaptik plastisiteyi bozarak hafızayı olumsuz etkileyebilir. CB1 reseptör etkidaşlarının , NMDA glutamat reseptör aracılı kalsiyum akışını bastırdığı gösterilmiştir, sonuçta bellek oluşumunu bozabilecek daha az CREB fosforilasyonu ve sinaptik plastisiteyle sonuçlanmıştır. [184][185]
Δ 9 THC, bellek için önemli olan çoklu aşağı yönlü sinyal yollarını etkileyen CB1 reseptör aktivasyonu vasıtasıyla hafızayı bozduğu görülmektedir. CB1 aktivasyonunun, COX-2’yi aktive ederek hafızayı bozduğu gösterildi; bu, COX-2 önleyicilerinin Marijuananın çalışma belleğine olan olumsuz etkilerinin bazılarını iyileştirdiğini düşündürüyor. CB1 aktivasyonunun, hafıza oluşumu için önemli olan NMDA glutamat reseptör aracılı kalsiyum akışını sınırladığı da gösterilmiştir.
5 Kalp ve Damar Sağlığı
5.1 Kalp Dokusu
Marijuana (Esrar) dumanının solunması istirahat halindeyken kalp hızını arttırdığı bilinmektedir. [343] [343] [344] Dinlenme kalp atış hızındaki bu artış başlangıçtan% 20-100 daha fazla değişir (sırtüstü ölçüldüğünde; ayakta dururken daha düşüktür), 10 dakika içinde solunur ve 2-3 saat sürer. [345] Marijuanada maximum altı egzersiz sırasında kalp atış hızını arttırırken, [343] yoğunluklarda azami % 80’i aşan hiçbir farklılık gözlenmemiştir ve gruplar arasında maksimum egzersize bağlı kalp hızında herhangi bir farklılık bulunmamaktadır. [343]
Esrar içme üzerine kalp atım hızındaki artış, ağır kullanıcılar tarafından bile görülebildiği ve algılanan yüksek ile ilişkili olduğu öne sürülmüştür. [211] Buna karşılık, bir çalışmada, bir hafta boyunca oral sentetik Δ 9THC uygulamasıyla subjektif zehirlenmedeki zayıflamanın, kalp atım hızının psikotropik etkilerden bağımsız olarak artabileceğini öne süren kalp atım hızı ile karşılanmadığı kaydedilmiştir. [346] Δ 9 THC’nin daha uzun süreli kullanımı kalp hızının normalleştirilmesi ile değil, başlangıç durumuna göre kalp atış hızında refrakter azalma ile de ilişkilidir. [235]
Hem Marijuana kullanımı hem de saf Δ9THC’nin ağızdan alınması ile ilgili kalp atışlarında bir artış yapar. Artış, Marijuana’ın psikoaktif etkilerine göre keskin bir şekilde artmış gibi görünse de, kalp atış hızındaki artış, daha uzun süreler boyunca psikoaktif etkilere karşı toleransa zayıflatmaz. Aslında, Δ 9 THC’ye uzun süreli maruz kalma ile kalp hızı bazal seviyenin altına düşebilir.
Marijuana’nın neden olduğu kalp hızı artışları, beta blokerleri [237] [236] veya atropin ile zayıflatılabilir; bunların kombinasyonu kalp hızı veya diğer kardiyak önlemlerdeki değişiklikleri neredeyse tamamen ortadan kaldırır. [347] Bu, Marijuana (Esrar) maddesinin kalp hızı artan etkilerine kolinerjik (atropin) ve adrenerjik (beta blokerler) mekanizmaların aracılık ettiğini göstermektedir.
Bu etkiler merkezi sinir sisteminden kaynaklanabilir, çünkü Δ 9 THC, bu ilacın duyarsızlaşma etkileri ile ilişki gösteren bir şekilde ön singulat kortekse kan akışını arttırdığı kaydedilmiştir. [243] Marijuana (Esrar) solunmasıyla güçlendirilmiş bu beyin bölgesinin aktivitesi [348] ayrıca kardiyovasküler fonksiyonun düzenlenmesinde rol almaktadır. [349] [350] Ön singulat korteksin, Marijuana (Esrar) kalp atım hızı üzerindeki zaman seyri ile ilişkili olarak, kronik kullanımla (muhtemelen atrofi ile sonuçlanan) hipoaktivite geliştiği gözlenmiştir.[351][352]
Marijuana’nın kalpteki eylemleri, direkt olarak değil, merkezi (beyin aracılı) araçlar vasıtasıyla ortaya çıkmaktadır ve anterior singulat korteksin artmış aktivitesi ile ilişki göstermektedir.
Kannabinoid reseptör CB1, aktivasyonunun serbest radikal üretiminin artmasına ve hücre ölümüne neden olan Mitojen Aktive Edilen Protein Kinazı (MAPK) aktivasyonuna yol açtığı insan aort damarından endotel hücrelerinde tespit edilmiştir. [353] [354] Bu dokular, aktif hale getirildiğinde anti-iltihaplanma etkilere sahip olduğu görülen CB2 reseptörlerini de ifade eder (iltihap tarafından uyarılan) yapışma faktörleri baskılanarak bu dokulara daha az bağışıklık hücresi yapışması sağlar. [355] [356]
- MAPK : Bir mitojen ile aktive edilen protein kinazı, serin ve treonin amino asitlerine özgü bir protein kinaz türüdür.
Kannabinoid reseptörler CB1 ve CB2 kardiyovasküler sistem boyunca eksprese edilir. Ne Marijuana (Esrar) tüketimi onları ne derece aktifleştirebilir ne de ortaya çıkan fizyolojik tepkiler iyi bilinmemektedir.
5.2 Damar Tıkanıklığı
Damar tıkanıklığı, yağ birikimlerinin ve bağışıklık hücrelerinin kan damarlarının duvarlarına girerek ilerleyici daralmaya ve kan akışının kısıtlanmasına neden olduğu kronik iltihaplanmaya dayalı bir hastalıktır. Kannabinoidlerin hem bağışıklık bastırıcı hem de anti-iltihaplanma özelliklere sahip oldukları belirtilmektedir. [357] [358] [359] Damar tıkanıklığı için terapötik olabileceklerini düşündürmektedir. [360]
CB2’nin, hastalıklı arter duvarında bu reseptörü eksprese eden bağışıklık hücrelerinin birikimi nedeniyle hastalıklı arterlerde yukarı doğru düzenlendiği bulunmuştur. [360] Dikkate değer olarak, CB2 reseptörü aracılığıyla sinyal gönderilmesi hem bağışıklık bastırma hem de anti-iltihaplanmadır, CB2 reseptörleri yoluyla kanabinoid sinyallemenin damar tıkanıklığı plakların oluşumunu baskılayan negatif bir geri bildirim mekanizmasının bir parçası olabileceğini düşündürmektedir.
Bu fikre uygun olarak, okside olmuş lipitleri sardıktan sonra gelişen makrofajlara zarar veren insan köpük hücrelerinin, türetildikleri makrofajlardan daha fazla miktarda CB2’ye sahip olduğu bulunmuştur. [361] [362] Laboratuvar ortamındaki kanıtlar, makrofajlar üzerindeki CB2 reseptörünün aktivasyonunun, makrofaj alımını azaltarak ve oksitlenmiş lipid damlacıklarının birikimini baskılayarak damar tıkanıklığına karşı koruyucu olabileceğini göstermiştir; köpük hücrelerinin birikiminin azalmasına neden olmuştur. [361] [362]
CB2 reseptörünün anti-damar tıkanıklık etkileri ayrıca laboratuvar ortamında doğrulanmıştır; burada ApoE – / – farelerinde günlük olarak 1 mg / kg’lık (zirve efektif dozda) Δ 9 THC, CB2 reseptörü vasıtasıyla Damar tıkanıklığının ilerlemesini engelliyordu. [360] Dikkat çekici olarak, bu çalışmadan elde edilen serumdaki Δ 9 THC konsantrasyonu, psikoaktif etkiler için gerekli seviyelerin çok altındadır.
Laboratuvar ortamında ve hayvan verileri, Δ 9 THC vasıtasıyla CB2 reseptörünün aktivasyonunun, Damar tıkanıklığının ilerlemesini azaltan bir anti-iltihaplanma etki sağladığını ileri sürmektedir. Bu, psikoaktif etkiler için gerekli olanın altında olan serum konsantrasyonlarında görülür.
CB2 reseptörünün aktivasyonu, makrofajlar tarafından biriktirilen, oksitlenmiş LDL kolesterolün (oLDL) miktarını azaltarak, bağlayıcı protein CD36’nın (makrofaj bağlama reseptörü olarak adlandırılan) aşağı yöne düzenlenmesine ikincil olarak işlev görmektedir. [362]
CD36, oLDL’yi biriktirmek ve köpük hücrelerinin üretimini başlatmak için merkezi bir konudur ve oLDL’ye bağlandığında başlatılan iltihaplanma süreci boyunca arttırılmış kendi ifadesine sahip olduğu bilinmektedir. [364] [365] Bu iltihaplanma, TNF-α, IL-10 ve IL-12 iltihaplı proteinlerde daha sonra bir azalma ile kanıtlandığı üzere, CB2 aktivasyonu ile azaltılır. [362]
- TNF-α, IL-10 / IL-12 : İltihaplanma ve bağışıklık hücre,peptid ve proteinleridir
CB2 aktivasyonuna ikincil hali hazırda oluşturulmuş köpük hücrelerinden bir kolesterol akışı olabilir, çünkü CB2 aktivasyonunun belirtildiği ATP-Bağlayan Kaseti alt ailesi G üyesi 1 protein seviyelerinde, aşırı kolesterolün hücrelerden taşınmasından sorumlu olan bir artışa neden olmuştur. [366]
Bazı kanabinoidlerle (en önemlisi kanabidiol metaboliti CBDD) görülen 15-lipoksigenaz bastırmasının LDL oksidasyonunu azaltmada bir rolü olduğu varsayılmaktadır; [121] çünkü bu enzim aktif olduğunda LDL’yi okside edebilmektedir [367] ve kanabinoidler oldukça lipofiliktir ve plazmada bu lipoproteinler tarafından taşınırlar. [72]
Oksidasyona uğramış LDL kolesterolün makrofajlara alınması, damar tıkanıklığı birikim için kritik bir faktör olan köpük hücreler üretir. CB2’nin Δ 9 THC vasıtasıyla etkinleştirilmesi, okside LDL’nin makrofaja bağlanmasını önleyerek alımını azaltır ve nihai olarak köpük hücre üretimini azaltır gibi görünür.
CB2’nin aksine, kanabinoid sinyal sisteminin CB1 reseptörü üzerinden aktivasyonu proaterojendir, ancak CB1’i inhibe eden bazı bileşikler de yararlı olabilecek kafa karıştırıcı etkilere sahiptir.[371] [372] CB1 reseptör aktivasyonunun, makrofajlarda kolesterol birikimini arttırdığı ve köpük hücre oluşumuna yol açtığı gösterilmiştir. [373] Bu, CB1 reseptör etkidaşları rimonobantın LDL reseptör eksikliği olan farelerde Damar tıkanıklığını bastırdığı laboratuvar ortamında teyit edilmiştir.
Marijuana (Esrar) CB1 ve CB2 reseptörlerini benzer afinite ile aktive ederken, bağışıklık sistemindeki hücreler çok daha yüksek seviyelerde CB2’ye sahip olma eğilimindedir ve bu da, oral yoldan alındığında karışık etkidaşı Δ 9 THC’nin nihayetinde farelerde koruyucu etkilere neden olduğunu açıklayabilir. [360] Dahası, CB1 aktivasyonunun olumsuz etkileri, Δ 9 THC’nin faydalarının neden doza bağımlı olmadığını açıklayabilir. [360]
Makrofajlar geleneksel olarak köpük hücre oluşumunun kaynağı olarak kabul edilmesine rağmen yerleşik vasküler düz kas hücreleri köpük hücreler haline gelebilirler. [375] [375] Vasküler düz kas hücrelerinde yaygın olarak lipid birikimini azaltan bir proteini olan Geçici Alıcı Potansiyel Vaniloid Tip 1 (TRPV1) reseptörü, Marijuana’da bulunan bileşenler tarafından aktive edildiği bilinmektedir (377). [378] [379]
Bu, köpük hücre oluşumunu azalttığı bilinmektedir. [380] Bu reseptör makrofajlarda da bulunur ve bunlardan türemiş köpük hücrelerde aşağı düzenler, ancak bu hücrelerdeki aktivasyon aslında lipid damlacık birikimini artırabilir. [362]
5.3 Kan Basıncı
Marijuana (Esrar) içilmesinin, ağır kullanıcılar olarak tanımlanmayan sağlıklı kişilerde istirahat tüm vücut ve kalp kan basıncını artıracağı gibi, birçok çalışmada ya herhangi bir etki ya da azalma görülmemiştir. Örneğin, ağır kullanıcılar, Δ 9 THC verildiğinde kalp kan basıncında herhangi bir değişiklik ya da potansiyel bir düşüş görmüyor, çünkü füme Marijuana (Esrar) ile de görülüyor. [381] Altı günde sürekli izole edilen Δ9 THC ağır kullanıcılar için yapılmış bir başka çalışma da tutarlı bir hipotansif etki gösterdi. [346]
Glokom hastalarının, sıklıkla postüral hipotansiyon ile ilişkili olarak Marijuana (Esrar) kısa süreli olarak teneffüs ederken kan basıncında azalma olduğu görülmüştür. [382] Kan basıncındaki değişiklikler kalp basınç ile daha belirgin gözükmektedir ve kalp atışlarında meydana gelen değişiklikler yanında ortaya çıkma eğilimindedir. [344] [343]
Artan kan basıncının kısmen, kalp atış hızını arttırdığı ve kan basıncında Kısa süreli artışlar yaptığı bilinen beyindeki CB1 reseptörleri üzerindeki THC’nin hareketi ile tahrik edilebilir. [383]
Sınırlı kanıt, Marijuana içmeyen kişilerin kan basıncında ciddi bir tecrübe ve Kısa süreli bir yükselme gösterebileceğini düşündürse de, bu artışların toleransa tabi olduğu ve ağır kullanıcılardaki dinlenme kan basıncında refrakter azalmaya neden olabileceklerine dair daha fazla kanıt bulunmaktadır.
Marjuauna kullanımının (en az bir yıl boyunca ayda en az 25 kez kullanım) aniden kesilmesi, ilk üç günlük kalp atım hızı ile ilişkili olmayan bir şekilde tüm vücut (% 7.8), kalp (% 9.3) ve ortalama arteriyel kan basıncındaki (% 8.7) artışla ilişkiliydi. Marijuana (Esrar) tekrar kullanıldığında bu değişiklikler normalleştirildi [384] ve bu çalışmadaki çoğu hasta (% 69) hipertansiyon kriterlerine uyacak kadar geniş artışlarla karşılaşmadı. [384]
Kronik Marijuana (Esrar) kullanımının aniden durdurulması, kan basıncında refrakter artışa neden olabilir.
5.4 Trombositler ve Akışlanlık
Laboratuvar ortamındaki kanıtlar, Marijuana (Esrar) maddesinin bazı bileşenlerinin, ADP kaynaklı trombosit kümelenmesini bloke ederek bunu bastırabiliceği göstermektedir. [385] ADP’nin uyardığı kümelenme doza bağlı bir şekilde, en güçlü olan kannabigerol ile bastırıldı ve ardından kannabidiol, olivetol, Δ1THC ve kanabinol ile potensi azaltıldı. [386] Kannabinol ve Δ 1 THC’nin neden olduğu bastırma , daha yüksek seviyelerde ADP eklenerek karşılanmaktadır. [387]
- ADP : Metabolizmada önemli bir organik bileşiktir ve canlı hücrelerde enerji akışını sağlar.
- IC 50 : Bir maddenin belirli bir biyolojik veya biyokimyasal işlevi bastırma gücünün bir ölçüsüdür.
Serotonin trombositler tarafından alınır ve depolanır; bu trombositler aktive edildiğinde serotonin salınır ve bu hem bir damar büzücü hem de ilave kümelenmelerin bir aktivatörü olarak işlev görür. [388] Saf DU 9 THC 30-70 mg’da Kısa süreli olarak trombosit serotonin alımına bağlı olarak Δ 9 THC’nin rekabet edilemeyen bastırması çok yüksek konsantrasyonlarda ortaya çıktığı için, [133] trombosit serotonin konsantrasyonunu başlangıçtan iki saat sonra başlangıçta görülen değere değiştirecek gibi görünmemektedir (IC 50 139 uM). [389]
Migren hastalarının trombositlerinden serotonin salınımı da benzer seviyelerde engellendi. [390] Bir laboratuvar ortamındaki çalışmada, kannabinoid kolesterolünü bastırma kabiliyeti ile kanabinoidlerin serotonin salınımının bastırmasının ilişki göstermediğini bulmuştur. [386] Buna rağmen, erkek orta dereceli Marijuana (Esrar) kullanıcıları (2-12 yıl boyunca haftada 3-7 füme), trombositlerde serotonin alımına yönelik az miktarda maksimum başlangıç hızının, içilen olmayan kontrollerle karşılaştırıldığında (bu etki kadınlarda gözlenmedi) göründü. [389]
5.5 Trigliserid
Wistar farelere karıniçi 10 mg / kg vücut ağırlığı Kannabinol enjeksiyonu, trigliserid düzeylerini etkilemedi, ancak 5 mg / kg THC enjeksiyonunun anlamlı şekilde yükseldiği görüldü. [391]
Farelerde bulunmasına rağmen, Marijuana (Esrar) maddesinin trigliseridler üzerindeki etkileri insanlarda görülmez. Marijuana (Esrar) kullanımını inceleyen geniş bir uzunlamasına çalışma, genç kullanıcılardaki Marijuana (Esrar) kullanımı ve yükselmiş trigliserid düzeyleri arasında bir ilişki bulmuş olsa da, eşzamanlı alkol kullanımı dikkate alındığında bu ilişki kaybolmuştur. [392]
Daha küçük bir vaka kontrol çalışması, Marijuana (Esrar) kullanımı ile trigliserid düzeyleri arasında herhangi bir ilişki bulamamıştır. [393] Yetişkinlerde kendinden rapor edilen Marijuana’nın geçmiş veya günümüzdeki kullanımını inceleyen ek bir araştırma, trigliserit seviyeleri ile hiçbir ilişki bulamamıştır. [394]
Gözlemsel insan kanıtlarına dayanarak, karışıklığa neden olanlar hesaba katıldıktan sonra, Marijuana kullanımı ile trigliserit seviyeleri arasında hiçbir ilişki yok gibi görünüyordu.
5.6 Kolesterol
Wistar farelere karıniçi 10 mg / kg vücut ağırlığı Kannabinol enjeksiyonunun HDL düzeylerini düşürdüğü, 5 mg / kg’lık bir enjeksiyon hem HDL hem de toplam kolestrolü düşürdüğü gözlendi. [391]
Gözlemsel çalışmalar, Marijuana (Esrar) kullanıcıları arasında total kolestrol düzeyindeki değişiklikleri [392 ] ve HDL-C’de bir azalma, [393] artış, [395] veya hiç değişiklik [392] [394] not etmeyi başaramamıştır. Marijuana (Esrar) aktif bileşenlerin kolesterol üzerindeki etkileri ile ilgili girişimsel araştırma yapılmamıştır.
Toplam kolesterol ve LDL-C araştırıldığında benzer bir karışık sonuç kaydedilirken, bir çalışmada olası bir azalma bildirilmiştir ve başka birinde önemli bir değişiklik bildirilmemiştir. [392][395]
Marijuana’ın kolesterol düzeyleri üzerine olan güncel araştırması sonuçsuz kalmaktadır.
6 Glukoz Metabolizması ile Etkileşimleri
6.1 İnsülin
Marijuana (Esrar) kullanımı şimdiye kadar Marijuana (Esrar) kullanılmadığını bildirenlere göre açlık insülin konsantrasyonlarında azalma (çoklu karıştırıcılar için ayarladıktan sonra% 16) ile ilişkili görünmektedir. [394] Bu azalmanın pankreatik hasara bağlı olduğu düşünülmemektedir, zira farklı bir vaka kontrol çalışması Marijuana (Esrar) kullanımı ve β-hücre fonksiyonu ile herhangi bir ilişki bulamadı. [393]
- Adiponektin : Adiponektin, glikoz seviyelerini ve aynı zamanda yağ asidi dökülmesini düzenleyen bir protein hormonudur.
Şu anda iyi anlaşılmamış olmasına rağmen, açlık insülininde Marijuana (Esrar) nedeniyle uyarılan azalmalardan sorumlu mekanizmalar, adiponektin düzeylerini artırabilen, insülin duyarlılığının artmasına neden olan zayıflama CB1 reseptör sinyali vasıtasıyla ortaya çıkabilir ve bu nedenle insülinin üretimini azaltabilir. [394][397] Bu fikirle uyumlu olarak, CB1 reseptörünü deney farelerinde, diyetle uyarılan obeziteye dirençlidir; bu, bu reseptörün glukoz homeostazında önemli bir rolü olduğunu düşündürür.
Ayrıca, kanabinoid reseptör etkidaşı THC’yi içermesine ek olarak, Marijuana (Esrar) ayrıca kanabinoid reseptör etkidaşı olan Kannabinol de içerir. Bu nedenle, Marijuana (Esrar) maddesinin bilinen veya henüz tanımlanamayan bileşenleri, CB1 reseptörü aracılığıyla azalan sinyal vasıtasıyla yönlendirilen bir adiponektin aracılı mekanizma ile açlık insülin konsantrasyonlarını azaltabileceği akla yatkındır.
6.2 İnsülin Duyarlılığı
Homeostaz Modeli İnsülin Direncinin Değerlendirilmesi (HOMA-IR) ile hesaplanan insülin duyarlılığı, esrar kullanmayan kontrollerle karşılaştırıldığında, esrar kullananların (son 30 günde en az bir kez kullanılmış) daha yüksek olduğu görülmüştür. Ancak Marijuana kullanımı ile insülin duyarlılığı arasında doz bağımlılığı gözlenmedi. [394]
İnsülin duyarlılığında bu artış, bir önceki çalışmadan farklı olan insülin duyarlılığının hesaplamalarını kullanmasına rağmen, uzun süreli ağır Marijuana kullanıcılarının bir diğer çalışmasında (9.5 yılda günde ortalama altı füme ortalaması) gözlenmemiştir. Bununla birlikte, kronik kullanıcılar üzerinde yapılan çalışma, diğer insülin duyarlılık ölçümlerinde bir değişiklik olmamasına rağmen yağ hücresi insülin direncinde bir artış olduğunu ortaya koymuştur. [393]
Gözlemsel çalışmalar, Marijuana (Esrar) maddesinin insülin duyarlılığı üzerindeki etkisine ilişkin karışık sonuçlar vermiştir. Bir çalışma, yakın tarihli kullanımın duyarlılığı artırabilirken, bir başka çalışmada uzun süreli ağır kullanıcılarda herhangi bir etki bulunmadığını belirtti. Dolayısıyla, marjijuana’nın farklı popülasyonlarda insülin duyarlılığı üzerindeki etkileri tam olarak anlaşılamamıştır.
6.3 Kan Şekeri
Ulusal Sağlık ve Beslenme İnceleme Araştırması (NHANES III) verilerine göre, Marijuana (Esrar) kullanmayanların (97.8 mg / dL) daha önce ve geçmiş Marijuana kullanıcılarının, açlık glukoz konsantrasyonları daha düşüktür (92.3-93.1 mg / dL). [395] Buna karşın, Marijuana (Esrar) maddesinin karbonhidrat metabolizması üzerindeki Kısa süreli etkilerini inceleyen küçük bir çalışma, sigara içtikten sonra kronik Marijuana (Esrar) kullananlarda beslenen aç bırakılmış durumda hipoglisemi bulgusu bulamamıştır. [399] Çünkü Marijuana’ın kan şekeri üzerindeki etkilerinin belirginleşebileceğini önermektedir.
6.4 Glikojen
Marijuana’nın glikojen üzerindeki etkileri üzerine herhangi bir klinik çalışma bulunmamaktadır. Bununla birlikte, hayvan modellerinden ve laboratuvar ortamında deneylerden elde edilen bazı veriler mevcuttur.
Hayvan modellerinde, farelere Marijuana (Esrar) ekstraktının Kısa süreli uygulanması, karaciğerdeki glikojen depolarını azaltır. [400] Marijuana (Esrar) özüne tekrar tekrar maruz kalma, farelerde uterin glikojen depolarını azaltır. [401]
İnsan dokusu kullanılarak yapılan dolaylı laboratuvar ortamında kanıt, kanabinoid sistemin glikojen düzeylerini etkileyebileceğini düşündürmektedir. AMP-aktive protein kinaz (AMPK), hücresel bir enerji algılayıcısı olarak işlev görür, kas hücrelerinde glikojen sentezini engeller ve enerji homeostazı ile ilişkili diğer metabolik süreçlerin arasında yer alır. [402] Endokannabinoid sistemi insan iskelet kasında bulunur ve AMPK da dahil olmak üzere çeşitli proteinlerin sentezini etkileyen CB1 antagonizması ile oksidatif enerji metabolizmasında rol oynar.
- AMPK : Hücresel enerji değişiminde rol oynayan bir enzimdir.
Bununla birlikte, enerji homeostazının hücresel ve moleküler kontrolü oldukça karmaşıktır, ayrıca bir rol oynayan ve resmi karmaşıklaştıran bir dizi başka reseptör ve sinyal yolu gerektirir.[403] Bu ilave reseptörlerin bazıları Geçici Alıcı Potansiyel kanalı-Vaniloid alt aile üyesi 1 (TRPV1) ve CB2’yi içerir. [404] Fare çalışmaları, Δ 9 THC kullanan CB1 agonizminin AMPK aktivitesini etkilemediğini göstermektedir. [405]
6.5 Glikasyon
NHANES III’ten elde edilen veriler, Marijuana’ın mevcut ve geçmiş kullanımının, serumda artan HbA1c yaygınlığının önemli ölçüde azaldığı (% 6.0-4’ü aşan kullanıcıların% 3.2-4.2’si), Marijuana (Esrar) kullanmamış olanlara kıyasla daha düşük olduğunu ortaya koymaktadır (Örneklemin% 8.7’si HbA1c’yi% 6.0’dan fazla). [395] Bununla birlikte, NHANES III verilerini kullanan başka bir araştırma, ayarlanmamış ortalama HbA1C düzeyleri şimdiki ve geçmiş kullanıcılarda anlamlı olarak düşük olmakla birlikte, veriler muhtemel karıştırıcılar için ayarlandıktan sonra kayboldu. [394]
- HbA1c : Son iki ila üç ay boyunca ortalama kan şekeri (şeker) seviyelerinizdir.
6.6 Tip I Diyabet
Vaka incelemeleri topluluğu, Marijuana (Esrar) kullanımının, keton konsantrasyonu ve semptomlarına göre kan asitliği açısından beklenenden az artışla ketoasidozu ‘maskeleyebileceğini’ önermektedir. Bu ketonüri, damariçi insülin ile giderildi. [406] Ayrıca, obez farelere verilen Marijuana’ın, kilo verme ve pankreas ağırlığında bir artış ile ilişkili olduğu ve pankreas beta hücrelerinin koruyucu bir etkiye sahip olabileceğini düşündürdüğü kaydedildi. [407] Bu, bazı hayvan modellerinde Marijuana’nın başta gelen tip I diyabetini önleyebileceğini önermektedir.
6.7 Tip II Diyabet
NHANES verilerinin kesitsel bir analizinde, şimdiki veya eskiden Marijuana (Esrar) kullanıcılarının, Marijuana (Esrar) kullanmadan (genelde olasılık tahmini 0.42 ve% 95 güven aralığı 0.33-0.55) karşılaştırıldığında, tip II diyabet riski düşüktür. Bu çalışmada, geçmiş kullanıcılar (olasılık tahmini 0.44,% 95 güven aralığı 0.33-0.59), hafif akım kullanıcıları (olasılık tahmini 0.29,% 95 güven aralığı 0.13-0.65) ve ağır kullanıcılar (olasılık tahmini 0.47,% 95 güven aralığı 0.22-0.98) tip II diyabet için daha düşük risk altında bulundu. [395]
Bu koruyucu etkiler, iltihaplanma ile ilişkili bir mekanizmanın düşündüren serum C-reaktif proteinindeki azalmaların yanında ortaya çıkmıştır. [395] NHANES verilerini kullanan başka bir araştırmada Marijuana (Esrar) kullanıcılarında açlık insülininde azalma (% 16) ve insülin hassasiyetinde (% 17) düzelme olduğu bulundu. [394]
Marijuana (Esrar) raporunda kendi kendine Marijuana kullananlara kıyasla tip II diyabet gelişme riski önemli derecede azalmış gibi görünüyor.
7 Yağ Kitlesi ve Obezite
7.1 Adipokinler
Hem Marijuana (Esrar) [408] hem de dahili kanabinoid anandamid, oreksijenik (iştah artışı) etkilere sahiptir. 409] [410] Bir çalışmada, bir oreksijenik peptid olan ghrelinin iştah artışı etkilerinin kanabinoid reseptör etkidaşı rimonabant tarafından bloke edildiği bildirilmektedir. [411] Marijuana’ın iştah artışı etkilerinin bazılarının artan ghrelin seviyeleri yoluyla ortaya çıktığını düşündürmektedir. Dahası, rimonabant ghrelin salgılanmasını azalttı, bu da gıdadan yoksun farelerde gıda alımının azalmasına neden oldu. [412]
Hipotalamus CB1 reseptörlerinde oldukça zenginleştirilmiş [413] [411] ve kemirgenlerde rimonabant, beyindeki bu bölgeye doğrudan infüze edildiğinde ghrelinin iştahı uyarıcı etkilerini bloke ettiği gösterilmiştir. [411] Böylece iştah kontrolü için önemli olan hipotalamus bölgelerinde CB1 reseptörlerini aktive eden artmış ghrelin seviyeleri ile Marijuana’ın iştahı uyarıcı etkileri ortaya çıkar.
Marijuana’nın insanlarda ghrelin düzeylerini doğrudan arttırdığı gösterilmiştir. Füme Marijuana’ın HIV pozitif erkeklerde nöropatik ağrı üzerindeki etkisini araştıran bir araştırmanın ileriye dönük bir alt grup analizinde [259] Marijuana (Esrar) solunmasının dolaşımdaki ghrelin% 42.4 (dağılım:% 27-59) olduğunu belirtti. [269]
Marijuana’ın solunması, iştahsızlık etkilerinden kısmen sorumlu olan ghrelin seviyelerini arttırır.
Bir hafta boyunca Marijuana’ın solunması, HIV ile enfekte bir toplumda bir ön denemede (“plasebo” da% 11.7’ye kıyasla) leptinin dolaşımdaki düzeyini büyük oranda artırdığı belirtildi. [269] Leptinin normal olarak iştahı baskılamak için eylemsizlik (iştah düşürücü) nöropeptitleri artırarak ve oreksijenik üretimlerin azaltarak düzenleme yapmakta olduğu için, Marijuana’ın artmış ghrelin seviyeleri ile iştahı tetiklediğini düşünürsek bu sonuç mantığa aykırıdır. [414] [415] [416]
Leptin seviyelerinde karşı-duyarlı Marijuana kaynaklı artışın popülasyona özgü veya hatta fonksiyonel öneme sahip olabileceği açık değildir. Marijuana’ın ghreline etkisi göz önüne alındığınde leptin düzeylerinin olumsuz bir geribildirim mekanizmasının bir parçası olarak artması mümkündür. HIV araştırmasında kalori alımı izlenmediği için [269] , leptin düzeyindeki artışın, leptin üretimi için bilinen bir uyarı olan artmış besin alımıyla meydana gelmiş olabileceği de göz ardı edilemez. [418]
Bir çalışmada, Marijuana’ın leptin düzeylerini arttırdığını belirtti. Büyüklük bakımından büyük olmasına rağmen, diğer çalışmalarla çoğaltılamaz. Bu nedenle, bu sonucun tekrarlanabilirliği ve pratik önemi net değildir.
7.2 Lipoliz (Yağların Ayrışması)
Peptid ghreline benzer Kanabinoidlerin yağ hücrelerindeki lipolizi doğrudan CB1 aktifleştirmesi yoluyla lipid birikiminde bir artışa neden olarak baskılayabileceği belirtilmektedir. [400] [420] Bu, enerji kullanımında yağ asitlerinden ve glukozdan uzaklaşmaya neden olur. [421] CB1 reseptörlerinin lokalize şekilde aktivasyonu, Marijuana (Esrar) kullananlarda görülen yağ insülin duyarlılığında tüm vücut insülin duyarlılığında herhangi bir değişiklik olmamasına rağmen artışı açıklayabilir. [393]
Laboratuvar ortamında çalışmalar, bu fenomenin gerçekten CB1 aktivasyonuna bağlı olabileceğini düşündürmektedir. [422] Bu etki kanabinoid konsantrasyona ve insülin varlığına bağımlı görünmektedir; Laboratuvar ortamındaki çalışmalar, 5μg / ml Δ9THC’nin trigliserit birikimini arttırdığını, buna karşılık insülin varlığında 2.5-10μg / ml Δ9THC’nin trigliserid birikimi ve adipogenezi baskıladığını göstermiştir. [423]
- Adipogenez : Yağ hücresinin ortaya çıktığı hücre farklılaşması sürecidir.
AMPK aktivitesinde düşüşe rağmen, yağ hücrelerinde glikoz alımı CB1 aktivasyonunun ardından gelişmiştir. [424] [405] Bu, artmış PI3K sinyallemesi yoluyla ortaya çıkıyor ve bu da GLUT4 mobilizasyonu ve glukoz alımını arttırıyor; [424] Dikkate değer olarak, PPARγ burada bir rol oynamaz. [425] İnsülin ile uyarılmış hem de bazal glikoz alımı, laboratuvar ortamında kanabinoidlerle güçlendirilmiştir. [424] [425]
- PI3K : Kas protein sentezini tetiklemek üzere aktive olan proteinler
- GLUT4 : Öncelikle yağ dokularında ve çizgili kaslarda (iskelet ve kardiyak) bulunan insülin ile düzenlenmiş glikoz taşıyıcısıdır.
- PPARγ : Makrofajların bir alt kümesinde de eksprese edilir ve doğal ve sinerji ligandlarına yanıt olarak birçok iltihaplanma gen ekspresyonunu negatif olarak düzenler.
Kannabinoidlerin anti-lipolitik etkilerini değerlendiren diğer çalışmalar, yağlı ve hepatik dokuda, hem periferik AMPK’yi (çoğunlukla karın yağ dokusunda) [405] hem de karnitin palmitoiltransferaz 1 (CPT1) [426] [427] bir bastırma bulmuştur ; nöronal dokularda yükselmiş olmasına rağmen. [405] [428]
Yağ hücrelerinde CB1 reseptörünün harekete geçirilmesi, yağ oksidasyon oranlarını düşürmekte, enerji kullanımını lipidlerden ve karbonhidratlara kaydırmaktadır.
Lipolizin bastırılmasının ötesinde, CB1 aktivasyonu aynı zamanda, adenilin siklaz bastırırken SREBP-1c, [429] [430] yağlı asit sintezi (FAS) ve lipoprotein lipaz (LPL) gibi proteinlerin ekspresyonunu arttırarak yağ oluşumunu artırabilir. [431] [432] Bununla birlikte, nükleer reseptör PPARγ’ın artmış aktivitesi nedeniyle yağ hücresi matürasyonunu ve trigliserit içeriğini arttırdığı da bildirilmiştir. [424] PPARy bloke edildiğinde yağ hücresi çoğalması ortadan kaldırıldığından, CB1 aktivasyonunun da yağ hücrelerinde çoğaltıcı bir etkiye sahip olduğu görülmektedir. [433]
7.3 Ağırlık
Endokannabinoid sistemin yeri spesifik bir etkisi olduğu görülmektedir ve obezite halindeyken deri altında bulunan vücut yağının endokannabinoid (anandamid ve 2-AG) konsantrasyonlarında görece bir azalma olduğu, [434] [435] [436] karın vücut yağının ise artırmaktadır. [437] [438] Bu farkın, bir yardımcı maddede dengesizliklerde rol oynayabileceği düşünülse de, birincisinde lipitlerin birikmesini tercih ederek deri altı vücut yağ oranı, kilo çevresini araştıran araştırmalar, esrar kullanıcılarının kontrollere göre hem artışlarını hem de azaldığını bulmuştur.
Birkaç çalışma, sağlıklı deneklerin ağırlığı üzerindeki esrar etkisine baktı ve sonuçlar çelişkilidi, ve Kesitsel gözlemsel çalışmalar, zaman içerisinde tek bir noktada veri toplayan düşük kaliteli çalışmalardır. Bu tür bir çalışma, daha fazla yağ kütlesi olan esrarla ilişkiliyken, diğerleri onu daha küçük bir bel, daha düşük vücut kütle indeksi ve daha düşük obezite yaygınlığı ile ilişkilendirmiştir. Yüksek kaliteli prospektif bir gözlemsel çalışma bile, kapsamlı esrar kullanımı ve daha yüksek vücut kütle indeksi arasında bir ilişki bulamadı. [392]
Bununla birlikte, bu çalışmaların hepsinin kendisinin bildirilen kullanıma dayandığını ve bu tür raporların her zaman bir ölçüde güvenilmez olduğunu unutmayın. Daha güvenilir yöntemler kullanan çalışmalar farklı bir tablo çiziyor. Üç klinik çalışma (katılımcıları büyük ölçüde gıda alımının kontrol edildiği ve hesaba katıldığı kontrollü bir hastane ortamına sınırlıydı) vücut ağırlığında artışlar gördü. [442] [443] [235] Bununla birlikte, her üç deneme de nispeten kısa sürelidir ve mütevazı örneklem büyüklüğüne sahiptir.
Esrar, gözlemsel çalışmalarda çok az kilo alması veya hiç almama ile ilişkilendirildi, ancak birkaç yüksek kaliteli çalışmada kilo alımı (klinik denemeler) ile ilişkilendirildi.
Araştırmacılar, zorlayıcı açlık veya tatlılar ve atıştırmalıklar için dayanılmaz istekler sonucu oluşan şişmanlığı tedavi etmek için endokannabinoid antagonistlerini (CB1’i bloke eden bileşikler) kullandılar. Bir endokannabinoid antagonisti olan anti-obezite ilacı rimonabant verilen sıçanlar kilo vermiş ve kandaki insülin seviyelerinde bir azalma yaşamıştır. [444] Aynı ilacın insan denemeleri, plasebo üzerinde 2.6-6.3 kg (5.7-13.7 lb) ağırlık kaybı göstermiştir. [445] Bu denemelerin çoğu, 9 ayda bir plato görmüş olanlar da dahil olmak üzere bir yıl boyunca sürdü. [446]
Bu başarılara rağmen, rimonabant ABD Gıda ve İlaç İdaresi’nden (FDA) onay alamadı ve mide bulantısı, baş dönmesi, şiddetli depresyon ve intihar düşüncelerini içeren yan etkiler nedeniyle Avrupa pazarından çekildi. [448] [449]
CB1’ler vücutta bulunduğundan, bu yan etkilerin nedenlerini ve mekanizmalarını belirlemek zordur. Yine de, gelecekte daha güvenli endokannabinoid antagonistleri, adiponektin üretimini arttırmak ve iştahı azaltmak için CB1’i bloke ederek obezitenin tedavisinde rol oynayabilir.
Rimonabant gibi CB1’i bloke eden ilaçlar ciddi kilo kaybına neden olur, ancak yan etkiler ciddidir. Yine de, endokannabinoid antagonistleri (yani CB1 blokerleri) üzerine gelecekteki çalışmalar obezite ile mücadelede atılımlara yol açabilir. Birçok insan kilo vermeyi dilese de, HIV ile ilişkili kas israf sendromu, kansere bağlı kaşeksi veya özellikle de yeme bozukluğu olan insanlar genellikle kilonun altındadır. Bu sorunu çözmek için iki sentetik THC bazlı ilaç geliştirilmiştir: nabilone (Cesamet®) ve dronabinol (Marinol®, Syndros®).
HIV ile ilişkili israf sendromu
HIV ile ilişkili bu kasıtsız, sürekli kilo kaybı sağlık sorunlarına yol açabilir. Oral kanabinoidler (dronabinol) kilo alımına yardımcı olabilir, ancak sonuçlar tamamen kesin değildir. [450] [451] Farklı çalışmalar tarafından kullanılan çeşitli dozlar optimalin altında olabilir. [452]
Kanserle ilişkili kaşeksi
Kansere bağlı iskelet kası kaybına kansere bağlı kaşeksi veya basitçe kanser kaybı ile denir. [453] İki büyük randomize kontrollü çalışma, günde iki kez 2,5 mg dronabinol (sentetik THC) vücut ağırlığını arttırdı, ancak sağlığı iyileştirmek için yeterli değildi. [454] [455] HIV israf çalışmalarında kullanılan dozlar gibi günlük 5 mg’lık bu doz yararlı bir etki ortaya çıkarmak için çok küçük olabilir.
Yeme Bozukluğu
İki küçük, kısa randomize kontrollü çalışma, THC’yi, yeme bozukluğu için bir tedavi seçeneği olarak araştırmıştır. [456] [457] Müdahale gruplarındaki insanlara 4 hafta boyunca günde iki kez 2.5 mg dronabinol verildi. Müdahale gruplarındaki insanlar, plasebo grubundakilerden ortalama olarak 0.70 kg [457] ve 0.73 kg [456] (1.54 lb ve 1.6 lb) daha fazla kazandılar. Bu artış azdır, ancak yine de bu nüfusa fayda sağlayabilir.
Doğal veya sentetik THC, HIV ile ilişkili israf sendromu olan kişilerde vücut ağırlığını artırabilir. Yeme bozukluğu veya kansere bağlı kaşeksi olan kişilerde, aynı etkiye sahip olabilir, ancak kanıtlar zayıftır.
8 İskelet Kası ve Fiziksel Performans
8.1 Müsküler Güç Çıkışı
Esrarın motor kontrolü üzerindeki bastırıcı etkisi, ağır kullanıcılarda (günlük olarak) 800mg Marijuana (% 3,7 Δ9THC) dozunun psikomotor performansını düşürmek için yetersizken, aynı miktarda esrarın% 5,5-6,4 Δ 9THC’sini azaltmada yetersiz kalmaktadır. [270]
Bir kavrama kuvveti testi ile değerlendirildiği gibi kendi kendine bildirilen Marijuana (Esrar) içenlerde Marijuana (Esrar) (18.2mg Δ 9THC kazandıran 1.4 g) Kısa süreli solunma güç çıkışını etkileyen edemedi. [344]
8.2 Aerobik Egzersizi
Esrar kullanımı sporcularda yaygındır, Olimpiyat sporcularının % 10’undan fazlası, IOC (1998-2003) tarafından yasaklanmış bir madde olarak kullanılmasından önce kullanıldığını bildirmiştir, bununla birlikte Olimpiyatlarda anabolik ajanların arkasındaki ikinci en çok kullanılan yasak maddedir. [25] Kullanımının fiziksel performans arttırıcı olarak görülen olmasa da, bunun nedeni kaygı ve gerginlik rahatlatma onun psikoaktif etkileri öncelikle kullanılacak düşünülmektedir. [25] [443]
Öğrenme bozukluğundan ötürü isteksiz öğrenmeye de başvurmak, (şartlı korku [459] [460]) esrarın rekabetle ilgili korkuyu azaltmak için de kullanıldığı düşünülmektedir. [25] [458] Bu fonksiyon, bazılarına göre [461] sonuçta performansta bir artış olduğu için performans arttırıcı olarak tanımlanmıştır.
Egzersiz konusunda (hem aerobik hem de anaerobik) esrarın doğal performans arttırıcı etkileri olduğu görünmemektedir. Atletlerde Marijuana (Esrar) kullanımı ‘performans arttırıcı’ bunu dikkate almak bazı önde gelen, ancak, rekabet ile korku ve anksiyete azaltmak için yardımcı olabilir.
Esrarın (18.2mg Δ9THC veren 20-25 füme 1.4 g Marijuana ) solunmasının, kalp atış hızını ve kalp kan basıncını keskin bir şekilde arttırdığı ve bunun bir bisiklet performansında sabit durum performansında kısa süreli bir % 25 düşüşe yol açtığı belirtildi ; (bisikletin 170 BPM’de hızda koruyarak); [344], plaseboya, kontrole göre sigara içmek performansı etkilemedi.
9 İltihaplanma ve Bağışıklık
9.1 İnterlökinler
Interleukin-6 (IL-6), normal olarak yaş ilerlemesiyle beraber artar, bağışıklık sistemi tarafından üretilen bir iltihaplanma ve bağışıklık düzenleyici proteindir. [447] Orta yaşlı Afrika-Amerikalı içinde Marijuana, Öz rapor kullanım Benzer yaşlı sigara içmeyen kohortlarda (kontrol değerinin% 58) ile karşılaştırıldığında daha düşük bir kalan IL-6 konsantrasyonları ile ilişkili gibi görünmektedir. [448] Bu kohort ortalama obez olmasına ve vücut kütle indeksinin serumda IL-6 ile de ilişkili olmasına rağmen, bu ve diğer sosyal ve fiziksel faktörler için ayarlandıktan sonra bile esrar kullanıcılarında IL-6 seviyeleri daha düşüktü. [463]
9.2 Doğal Öldürücü Hücreler
Kanabinoid sistemi, doğal öldürücü hücreleri etkiliyor gibi görünmektedir, çünkü immünolojik sinyallemede yer alan endokannabinoid 2-araşidonoillgliserol, NK hücrelerinin kısmen CB2 reseptörleri yoluyla göçünü uyardığı belirtilmiştir ; Δ9THC test edildiğinde, sadece doğal öldürücü hücrelerinin 1µM’de göçünü uyarmakla kalmadı aynı zamanda 2-AG’nin de aynı konsantrasyonda yapmasını engelledi. [466]
Özel olarak gösterilmemesine rağmen, bu farklılıklar CB2’ye bağlanma kuvvetindeki farklılıklar nedeniyle olabilir, çünkü 2-AG tam bir agonist iken, 9CH ve anandamid kısmi CB2 reseptörü agonistleridir. [467]
Δ9THC’nin hücre göçünü uyarmasının aksine, iki hafta boyunca damariçi 2.5 mg / kg kannabidiol (CBD) uygulamasının diğer lenfositlerdeki (B ve T hücrelerinde) azalmalara rağmen sıçanlarda doğal öldürücü hücrelerinin toplam sayısını ve yüzdesini arttırdığı görülmektedir. [468]
Kannabinoid sistemin doğal öldürücü hücre göçünde rol iken, Δ 9 THC ılımlı konsantrasyonlarda hücre göçü teşvik etmez.
Bhang kullanımı (1.5-3g günlük civarında) serum (% 26) sigara veya Marijuana kullanımını rapor etmeyen gençlere göreceli olarak, doğal öldürücü hücrelerin azaltılmış bir miktarı ile ilişkili gibi görünmektedir. Bu ilişki, 6-24 ay için kullanan belirtildiği henüz daha uzun süre kullanım rapor edenler içinde mevcut değildir. [454]
İmmünolojik parametreleri arasındaki ilişkiyi değerlendiren bir çalışma Cannabis sativa (Bhang gibi) kullanımına Bhang ilişkili doğal öldürücü hücre sayısı bir azalma kaydetti.
9.3 B Hücreleri
B Lenfositleri (B hücreleri) CB2 reseptörlerini doğal öldürücü hücreleri, makrofajlar, nötrofiller ve T hücrelerinden daha büyük bir dereceye kadar ifade eder ve bu reseptör için mRNA’nın potansiyel olarak lipopolisakarit ile laboratuar ortamında çeşitli proteinlere duyarlı olduğu görülmektedir.(CB2 mRNA’nın baskılanması ve STAT6’nın IL-4 arttırıcı CB2 reseptörü ifadesi yoluyla uyarılması.)
Bu reseptörün B hücrelerinde aktivasyonu, en az bir çalışma ile farklılaşmayı, göçü ve aktivasyonu arttırır, ayrıca B reseptörünün B hücrelerinin kuluçkalanmasından bu yana antikor sınıfının değişmesine neden olmasını sağlar ; kanabinoid agonistleriyle, IgM salgılanması pahasına CB2 antagonistleri tarafından bloke edilmiş bir şekilde immünoglobulin E’yi artırabilir. [462] Alerjik tepki olmaksızın IgE bir artış Marijuana solunması verilen birkaç durumda not edilmiştir. [463]
Laboratuar ortamında test edildiğinde, Δ9THC, anandamidin 1µM’ye kadar etkisiz olmasına rağmen, yardımcı uyaran maddelerin varlığında, 2nM’lik bir EC50 ile B hücresi çoğalmasında doza bağlı bir artışa neden oldu. [479]
- EC50 : Yarı maksimum tepki veren bir ilacın konsantrasyonudur.
- IgE : Bağışıklık sistemi tarafından üretilen antikorlardır.
Anti-iltihabik kanabinoid reseptörü (CB2) adaptif bağışıklık katılan B hücreleri, beyaz kan hücresinin belirli bir tür üzerinde çok büyük bir derecede eksprese gibi görünmektedir. Bu reseptör aktive edildiğinde, B hücreleri genel olarak aktive edilmesi ve IgE salgılanması diğer immünoglobulinler tercih edilebilir görünür.
Kronik esrar içicileri araştırılırken, başlangıç B hücre sayısı sigara içmeyen kontrollerden (Düşük bazal B hücre sayısı, sigara içmeyenlere göre kronik bhang kullanıcılarında da kaydedilmiştir [469]) daha düşük görünüyordu ancak bu, hastaneye yatırılan ortamlarda esrar kullanımıyla 64 gün boyunca normalize edildi.
Orada B hücresi aracılı bağışıklık açısından plasebo karşısında Marijuana etkilerini karşılaştıran kontrollü müdahaleler, ama kronik kullanıcıların kullanmayanlar daha düşük bazal B hücre sayısını var gibi görünüyor. B hücresi seviyeleri azalma Bununla birlikte, uzun süreli kullanımı ile korunmayabilir.
10 Hormonlar ile Etkileşimleri
10.1 Östrojenler
Birçok vaka çalışması, ağır Marijuana kullanımının sıklıkla, jinekomastinin (erkeklerde meme dokusu büyümesi) gelişmesini öngördüğü, Marijuana’nın erkeklerde normal hormonal dengeyi bozabilecek iç östrojenik özelliklere sahip olabileceğini göstermektedir. [465] [466] Bazı laboratuvar ortamında çalışmalar, bu doğrular; Her iki etanolik Cannabis sativa 24 um’lik bir THC içeriği eşdeğeri ile özü ve Marijuana (Esrar) duman yoğunluğu östrojen reseptörüne bağlanma için estradiol ile rekabet eder. [467]
Ancak bu THC’ye bağlı olmayabilir; Ne saf Δ9THC ne de metabolitlerinden on tanesinin östrojenik aktiviteye sahip olduğu belirtilmedi ve kannabidiol, sadece çok yüksek konsantrasyonlarda östrojenik aktivite gösterdi. [467] Dahası, esrar dumanı yoğunluğu ve esrarın birkaç bileşeni, canlı hayvan uterin doku modelinde, ne laboratuar ortamı çalışmaların biyolojik alaka düzeyini gündeme getirecek ne östrojenik ne de anti-östrojenik aktivite göstermiştir.[467]
Fitokanabinoidlerin, Cannabis sativadan, kültürdeki meme kanseri hücrelerinin östrojen reseptörünü uyarması veya bastırmasındaki başarısızlığı, başka bir yerde, esrarın iddia edilen östrojenik aktivitesini sorgulayan başka bir yerde belirtilmiştir. [483]
Laboratuvar ortamında, yöntemler kullanılarak yapılan yeni bir çalışmada, Marijuana duman yoğunluk bitkisel maddelerin yanmasından sonra oluşan fenolik bileşikler izlenebilmektedir bir estrojenik etkiye sahip olduğu bulundu. Bu nedenle, Marijuana dumanı, daha önce varsayıldığı gibi kannabinoidlerden ziyade, östrojenik polifenoller vasıtasıyla meydana gelen kendine özgü östrojenik özelliklere sahip olabilir. Cannabis sativa 500-5,000nM bir östrojen etkidaşı olan, [467] hem formononetin ise [468] den ve 4,4-dihidroksi-5-methoxybibenzyl Cannabis sativa [470] etkidaşlarıdır.
İnsan vakası çalışmaları, Marijuana (Esrar) östrojenik aktiviteye sahip olduğu düşündürmektedir. Östrojenik bir etki varsa, bu muhtemelen kannabinoidlerden ziyade esrarda bulunan doğal polifenollerden yanma ürünlerine atfedilir.
10.2 Androjenler
Cannabis sativa’yı sulu Bhang çözeltisi (6mg / mL’de) olarak beslenen sıçanlarda yapılan bir çalışmada, 36 günlük uygulama, vücut ağırlığının 6mg / kg’da daha fazla azaldığı, testosteronu 3mg / kg vücut ağırlığında bir dozda neredeyse yarıya indirdi. [4] Testosteron Bu azalma 3β-hidroksi steroit dehidrojenaz (3βHSD), testosteron sentezinin son enzim üzerinde bastırıcı etkilere olduğu düşünüldü. [4] Bir başka çalışma, THC’nin gonadotropinlerin bolluğunda bile olsa gonadotropin kaynaklı testosteron sentezini bastırabiliceğini ve testis dokusu düzeyinde bastırma olduğunu göstermiştir.
Başka bir çalışma, kanabinoidlerin gonadotropinlerin reseptörlere bağlanmasını engellemediği halde, testosteron sentezi için gerekli bir enzim olan kolesterol esterazı bastırarak hala testosteronu düşürdüğünü buldu. Bu etkiler aynı zamanda kannabidiol ve kannabinol ile de görülür ve THC’den daha etkilidir. [488]
Araştırma hayvan ve hayvan dokusunda, birkaç kanabinoid bileşenleri Cannabis sativa gibi THC olarak testosteron düzeyleri baskılayabilir.
İnsanlarda, 50 dakika boyunca 10 mg THC (% 0.02 olarak çözelti) damardan alımı 6 saatlik bir aralık boyunca testosteronda zamana bağlı bir düşüş göstermiştir. Kontrol grubu yaklaşık 5.5 +/- 0.5ng / mL testosteronda dalgalanırken, THC grubu, kandaki THC konsantrasyonlarının testten 1 saat sonra kaybolmasına rağmen 4-6 saatte 3.5 ± 0.5ng / mL’ye düştü. [489] Testeosteronda bir azalma, deneklerin esrar içtiği bir içtikten sonra da testosteron seviyelerinin, 3 saat sonra (kaydedilmemiş zamandan sonra) bazal değerlerin yaklaşık% 66’sına ulaştığı görülmüştür. [489]
Diğer çalışmalar,% 1-2 2.8 THC ekleminden sonra testosteron seviyelerinde anlamlı olmayan bir düşüş olduğunu, 20mg THC fümeden sonra testosteronda hafif bir (% 8) geçici azalma da dahil olduğunu göstermektedir. [491]
Bu çalışmaların her ikisi de, çalışma öncesi esrar kullanımı için kontrol altında tutulurken, daha büyük testosteron azaldıklarına dikkat çeken söz konusu çalışmalar yapmadı. [489] İlginç bir şekilde, izole THC kullanan bir çalışma testosteron seviyesi üzerinde herhangi bir etki bulamadı, bu da Esrar sativa bitkisindeki diğer bileşiklerin testosteron düzeylerini etkileyebileceğini öne sürdü. [492]
İki çalışma haftalık günlük içme oturumları veya 7 fümeye kadar (ya cinsiyet yada sigara içilmeyen koşullarında test) Marijuana kronik kullanıcılar testosteron önemli ölçüde farklı başlangıç seviyelerine göstermek olmadığını görüldü. [478] [479] Bununla birlikte, başka bir çalışmada, esrar içmeyen yaşa göre kontrollere kıyasla, en az 6 ay boyunca Marijuana kullanan erkeklerde testosteron seviyelerinin depresif olduğu görülmüştür. [495]
Düşüş gösteren tüm insan çalışmaları Marijuana kullanımı testosteron ikincil olarak davranışını etkileme olasılığının düşük olduğu yönünde, normal biyolojik aralıkta hareketsiz olduğu not edilmiştir.[481]
İnsan çalışmalar testosteron düzeyleri üzerinde Marijuana etkisi karışık sonuçlar vermiştir. Esrar içmek muhtemelen dolaşımdaki testosteron seviyelerinde ciddi bir düşüşe neden olur, ancak kronik, daha yoğun kullanımın testosteron üzerindeki etkisi çok daha az açıktır. Depresyonda testosteron düzeylerinin klinik önemi açık değildir ; birçok çalışma, dolaşımdaki hormon seviyelerinin düşmesine rağmen, normal aralıkta kaldıklarını gösteriyor olsa da.
Testosteronun bastırıldığı bir başka olası mekanizma da gonadotropin hormonlarının hipotalamik ve hipofiz çıktısını azaltmaktır, çünkü esrar kaynaklı testosteron bastırmasının belirtildiği bir çalışmada hCG uygulaması olarak, hCG’nin kabul edilmesinin bunu tersine çevirdiğine dikkat çekti.
Testosteron bastırmasının diğer olası mekanizmaları, testislerde testosteron sentezinin azalması, artan karaciğer konjugasyonu ve testosteronun metabolizmasını veya DHT’nin androjen reseptörüne bağlanmasını önleme yeteneğine sahip olan androjen reseptörü seviyesinde doğrudan antagonizmanın metabolizmasını içerir. Mümkün olan son mekanizma canlı hayvan çalışmalarında kaydedilmiştir, çünkü hadım edilmiş sıçanlar THC’den anti-androjenik etkiler yaşar ve bu etki dolaşımdaki testosteron seviyelerinden bağımsızdır. [499]
Testosteronla ilişkili etkilerin çoğu, endokannabinoidlerin CB1 reseptörü olmayan sıçanlarda testosteronu baskılayamadığı için esrarın hipofiz bezi üzerindeki etkisine bağlı olabilir. [501]
Esrar testosteron sentezini bastırmak için kullanılabilecek olası mekanizmalar çok sayıda, fakat azalmış testis testosteron sentezine çok bağlıdır.
Matematiksel bir uyarıma dayalı olarak Marijuana (Esrar) kullanımı, en fazla 48 saat boyunca testosteron düzeylerini baskılayabilir. [474] Çoğu zaman eğrileri, ancak, THC dolaşımdan giderildikten sonra da 4-6 saat tüketim sonrası testosteron maksimal bastırılması, göstermektedir. [474] [475]
10.3 Büyüme Hormonu
% 2.8’lik füme kısa süreli kullanımı, erkeklerde içtikten 2 saat sonra, kontrolle karşılaştırıldığında yaklaşık 1 ng / mL’den 2ng / mL’ye dolaşımdaki büyüme hormonu seviyelerinde hafif, istatistiksel olarak anlamsız bir artışla ilişkilidir. [475] Anormal derecede yüksek oral dozların (210mg) Δ9THC dolaşımdaki büyüme hormonu konsantrasyonlarını kısa süreli bastırdığı belirtilmiştir. [502]
10.4 Lüteinleştirici Hormon
Marijuana (Esrar) sigara kısa süreli azalmasının luteinize edici hormon (LH), erkeklerde seviyeleri neden olur. [475] Yaygın kullanımı (5-6 haftalık füme) taban LH düzeylerinde anlamlı olmayan bir artış ile bağlantılı olduğunu, ancak kronik kullanımı, depresyon, LH düzeyleri ile ilişkili değildir. [479]
10.5 Folikül Uyarıcı Hormon
Sigara içilmeyen koşullarda test edildiğinde Marijuana Kronik kullanım, erkek veya kadın folikül uyarıcı hormon düzeylerinde önemli değişiklikler ile ilişkili değildir. [479]
10.6 Kortizol
Bir çalışma, Marijuana dumanının solunmasının (% 2.8 Δ9THC içeren 1-2 sigaradan) sağlıklı erkeklerde psikoaktif etkilerin yanı sıra kısa süreli kortizolü artırdığını buldu.[475] Bu etkinin başka yerlerde, naif kullanıcılarda damariçi Δ9THC ile doza bağımlı bir şekilde ortaya çıktığı doğrulanmıştır, ancak kronik kullanıcılar benzer dozlarda kortizolde artış göstermediği için toleranslara maruz kalmaktadır. [2]
Değişimin büyüklüğü, eğlence amaçlı kullanımıyla ilgili Marijuana dozlar klinik açıdan anlamlı büyüklükte olduğu düşünülen kadar değildir ile belirtilen [488] ve kullanmayanlar için Marijuana kronik kullanıcıları karşılaştırırken kortizol gündüz ritminde hiçbir değişiklik yoktur. [477]
Çok yüksek dozlarda (210 mg) Δ 9 THC hastanede yatan hastalarda düşük kan glikoz kortizol yanıtı azaltabilir. [487] Bu etki için makul bir mekanizma, CB1 agonisti HU-120 ile sıçanlarda yüksek dozlarda gözlenen baskılanmış ACTH aktivitesidir. Buna karşılık, daha düşük dozların hafif bir uyarıcı etkiye sahip olduğu bulundu, bu mekanizmanın eş zamanlı olarak tolerans gösterebileceğini düşündürdü. [504]
- ACTH : Önde bulunan hipofiz bezi tarafından üretilen ve salgılanan bir polipeptit tropik hormondur.
Esrarın solunması, kortizolde kronik kullanımla zayıflatılmış kısa süreli bir yükselmeyi teşvik ediyor gibi görünmektedir. Normal kullanım ile belirtilen kortizol ani artışının genel büyüklüğü klinik olarak anlamlı değildir.
11 Vücut Organları İle Etkileşimi
11.1 Bağırsaklar
Kanabinoid sistemi bağırsakların düzenlenmesi ve patofizyolojisinde çeşitli roller oynar ve esrar ve bileşenleri, pro-iltihaplı mediatörlerin doğrudan baskılanması, bağırsak hareketliliğinin ve ishalin bastırılması ve içsel duyarlılığın azaltılması yoluyla teorik olarak bağırsak hastalıklarına yardımda rol oynayabilir. (505)
Spesifik olarak CB1 reseptörü, aktive edildiğinde bağırsak hareketliliğini azaltmada rol oynar ve hayvan modellerinde mide-bağırsak iltihaplanmasını azaltabilirken, CB2 aktivasyonu bağırsak iltihabını azaltır ve bağırsak hareketliliğinde küçük bir rol oynayabilirken, her ikisi de bağırsakla ilgili rahatsızlıklarda rol alabilir acı. [508]
İnsanlarda bağırsak hastalığı Marijuana etkileri sınırlı ama Marijuana (Esrar) iltihaplı bağırsak hastalığının semptomlarını azaltmakta etkili olabileceğini ortaya çıkarmaktadır. [494]
Kannabinoid sistemi bağırsak çeşitli roller oynamaktadır ve sınırlı insanlarda, esrarın iltihaplı bağırsak hastalıklarında yararlı olabileceğini düşündürmektedir.
11.2 Karaciğer
Esrar kullanımının, karaciğerde CB1 reseptörünün aktivitesinin karaciğerde (hepatik doku) karaciğerde lipogenez oluşturduğunu düşündüğü için alkolsüz yağlı karaciğer hastalığının (NAFLD) gelişiminde katkıda bulunan bir faktör olduğu düşünülmektedir, ve CB2 reseptörlerinin NAFLD’den etkilenen karaciğerde eksprese edildiği ancak sağlıklı karaciğerlerde görünmediği görülmüştür. [510]
CB1 aktive edildiğinde Mekanik olarak, laboratuvar ortamında lipojenik faktör SREBP-1 c ekspresyonu ve hedef enzimleri ACC1 ve yağlı asit sentezi (FAS) artmıştır [429] ve CB1 etkidaşlarının enjeksiyonu takip eden ağırlık ile ilişki farelerin karaciğerinde yağların oluşumuna neden olur. [429]
11.3 Pankreas
Esrarın solunmasının, acil durumlarda görülenlerin % 2’sinden az olmasına rağmen bazı kısa süreli pankreatit vakalarını hesaba kattığı belirtilmiştir (daha yaygın bir neden alkol olduğu için). [496] Esrarın tek nedensel maddesi olduğu kesin olmasa da, CB1 reseptörünün önceden var olan pankreatiti alevlendirdiği ve bu reseptörün bloke edilmesinin sıçanlarda hayatta kalma süresini uzatabileceği bilinmektedir. [512]
Marijuana (Esrar) pankreatit (Kısa süreli iltihabı) ağrıya neden birkaç durumda ile ilişkilidir. Bunun için esrar konusuna nedensellik konmamıştır, ancak kannabinoid sisteminin pankreatit hayvan modellerinde rol oynadığı görülmüştür.
Standart bir Batı diyetine maruz kalan sıçanlarda, Marijuana enjeksiyonları (5mg / kg Δ9THC’ye eşdeğer) yağsız sıçanlarda arzu edildiği zaman yiyecek alımını arttırmış, ancak obez sıçanlarda değil ve her iki grupta da kilo azalmış; Bu gözlem pankreas β-hücre fonksiyonunun korunması ile birlikte kaydedilmiştir. [407] Bu çalışma, bağımsız olarak (5mg / kg i.p.’de), pankreas seviyesinde sıçanlarda diyabet insidansını azaltabilen, esrar içeren esrar özütünü kullandı. [513]
Pankreas iltihabı olan diyabetik farelerde (streptozotosin ile uyarılmış), 150mg / kg’da iltihaplı stresörün yanında verilen Δ 9THC, bu organın korunmuş insülin içeriğiyle sonuçlanan ve kan glukozunda bir artışın azalmasıyla sonuçlanan pankreas iltihabını kısmen önledi. [514]
Esrarın pankreas üzerindeki etkilerini değerlendiren sınırlı hayvan kanıtı değişir; Kronik olarak Marijuana kullanımıyla koruyucu bir etki olsa da, Δ9THC ile görülen kısa süreli koruyucu etki çok yüksek bir doz gerektirir.
11.4 Akciğer
Marijuana (Esrar), hem bitki bileşenlerini ikincil olarak akciğerlere, hem de solunan herhangi bir yanıcı organik materyalin (bileşenlerine bakılmaksızın) akciğer dokusu üzerinde zararlı bir etkisi olabileceği için, solunum eylemi nedeniyle etkileri zararlı olabilir. [500]
Kronik Marijuana (Esrar) solunması eylemi, Kısa süreli ve kronik bronşit yanı sıra yanma sırasında üretilen uçucu maddelere benzeyen ve tütün içeren sigaralara benzer olduğu düşünülen hücresel displazi vakaları ile ilişkilendirilmiştir. [500]
Marijuana (Esrar) tütünü, sigarı dumanı ile benzer özelliklere sahiptir, çünkü ikisi de organik madde yanması nedeniyle akciğer dokusuna zarar verebilecek ve muhtemelen kanserojen rol oynayan zararlı yan ürünlere neden olurlar.
Kendi kendine bildirilen ağır sigara içenlerde (minimum haftanın dört günü) bir çalışma, test edildiğinde akciğer fonksiyonlarında veya akciğerdeki herhangi bir anormallikte başarısız oldu. [501] Marijuana (Esrar) bağımlı yetişkinlerin değerlendirmesinde, FEV1 / FVC’li deneklerin yüzdesinin kullanıcıların% 80’inden daha azı (% 36) kullanmayanlara (% 20) göre daha yüksektir. [502]
- FEV1 / FVC : FEV1 / FVC oranı, aynı zamanda Tiffeneau-Pinelli indeksi olarak da adlandırılır, obstrüktif ve kısıtlayıcı akciğer hastalığı tanısında kullanılan hesaplanmış bir orandır.
Marijuana (Esrar) toleransı durumu (bağımlı yetişkinlerin incelenmesi ile değerlendirilen), gece boyunca göğüs ağrısı, hırıltılı solunum (hastalığın dışında), ve egzersize bağlı nefes darlığı ile sabah uyandığında, daha önceye göre daha yüksek olan balgam üretimiyle de ilişkilidir. [502]
Bununla birlikte, genç yetişkinlerde Koroner Arter Riskin Gelişimi (CARDIA) çalışmasının bir parçası olarak 20 yıllık takip, düşük, ortak seviyelerde uzun süreli Marijuana (Esrar) kullanımının pulmoner fonksiyon ölçümleri üzerinde hafif bir pozitif etkiye sahip olduğunu tespit etti. Ağır kullanıcılar FEV1 ölçütünü baz çizgiden farklı değildi ve FVC ise ağır kullanıcılar için bile biraz iyileşme gösterdi, ancak çok ağır kullanıcılar için veri seyrektir. [503]
Marijuana (Esrar) içiciliğinin akciğer fonksiyonuna etkisi karışıktır; bazı gözlemsel çalışmalar akciğer fonksiyonları ve balgam üretimi üzerinde bir etki bulmuşken, Marijuana (Esrar) kullananlarda temel akciğer gücünü kullanmayanlara göre uzun süreli bir çalışma, çok az uzun vadeli etki bulmuştur.
Esrar bir bronkodilasyon (bronş genişlemesi) etkisine sahiptir ve 20 dakika içinde mevcut olan ve bir saat kadar süren eylemlerle kısa süreli sağlıklı kişiler tarafından solunduğunda FEV1 ve hava yolu iletkenliğini arttırabilir ; [504] Bu, Δ9THC içeriğinden kaynaklanıyor gibi görünmektedir, çünkü oral takviye de etkilidir, ancak plasebo veya sigaraların yavaş davranması ve solunması hava yolunun iletkenliğini kısa süreli bir şekilde bozmaktadır. [519]
Marijuana (Esrar) ile görülen bronkodilasyon, 7 mg / kg’da (% 1.7 Δ 9 THC) inhale edildiğinde egzersiz ile sinerjik olarak görünmemektedir. [343]
Esrarın kısa süreli solunumu hafif bir bronkodilasyon etkisine sahip gibi görünmektedir ve solunum yoluyla hava yoluna doğrudan uygulanmasından dolayı Δ9THC’nin oral desteğinden önemli ölçüde daha etkilidir ; bu etki yaklaşık bir saat sürer.
11.5 Gözler
Glutamat aracılı hücre zehirlenmesi, retina hasarının patofizyolojisinde önemli bir rol oynamaktadır [505] ve hem Kannabinol hem Δ 9 THC, bu yolla sinir koruyucu etkiler göstermek üzere,laboratuvar ortamında gösterilmiştir. [506] [507] [508]
Ek olarak, Marijuana (Esrar) bileşenleri göz içi basıncını etkiler; glokomlu kişilere verildiğinde, Marijuana (Esrar) yoluyla Δ 9 THC’nin dil altı (5 mg Δ 9 THC), [509] damariçi Δ 9 THC, [510] ve solunmasının göziçi basıncı plaseboya göre daha fazla düşürdüğü gösterilmiştir. Marijuana ile görülen göziçi basıncında azalma, solunmasından 60-90 dakika sonra en üst noktaya ulaşır, 30 dakika önce bir düşüş meydana gelebilir. [511]
Bu değişikliklerle, Marijuana’nın psikoaktif etkileriyle örtüşen bir konsantrasyonda periferik kan basıncındaki bir düşüşü paralelleştirir. [382] Bu etki toleranslara maruz kalabilir, çünkü düşük dozda Δ9THC (12mg) yalnızca bir kez esrar kullanımına özgü olanlarda etkinlik göstermiştir. [526]
Göziçi basıncındaki azalma, glokomdan muzdarip genç yetişkinlerde de kaydedildi. [511]
Marijuana periferik kan basıncındaki azalmaya bağlı olarak glokomlu kişilerde göz içi basıncını azaltabiliyor gibi görünmektedir ve bunun için gereken doz, psikoaktif bir etkiye sahip olmak için gerekli olana benzerdir; Göziçi basıncındaki bu düşüş toleransa bağlı olabilir.
11.6 Erkek Cinsel Organı
Testislerin farelerde hem CB1 hem de CB2 reseptörlerini ifade ettiği bilinmekte ve aynı zamanda kanabinoid metabolizmasının yağ asidi hidrolazını (FAAH) enzimini ifade etmektedir. [4]
- FAAH : Dahili kannabinoid anandamid ve uyku uyarıcı madde oleamid içeren endojen sinyalleme lipitlerinin yağ asiti amid ailesini bozan bir memeli integral hücre enzimidir.
- 3βHSD : Adrenokortikal yetersizliği olan bir ailedeki gendir.
36 gün boyunca farelerde oral olarak 3-6 mg / kg oral yoldan Bhang (% 25’den fazla Δ 9 THC içeriği ile Marijuana (Esrar) sativa yaprağı / çiçek özütü), testiküler ağırlığı doz bağımlı bir şekilde% 14-27 azaltmıştır. Bu, histolojik olarak değerlendirildiğinde testiküler toksisite ile ilişkili olduğu düşünülen azaltılmış serum testosteron ile birlikte 3βHSD ve FAAH aktivitesinde bir azalma ile ilişkiliydi. [4]
12 Kanser Metabolizması ile Etkileşimleri
12.1 Moleküler Hedefler
Kanser hücrelerindeki kanabinoid sistem normal hücrelerden farklıdır; kanser hücreleri çoğunlukla kanabinoid reseptörleri aşırı ifade eder ve kanser hücrelerindeki bu reseptörlerin seviyesi kanser gelişiminde kanabinoid sistemin bir rol oynadığını düşündüren, tümör saldırganlığı ile ilişki gösterir. [512]
Kanabinoidlerin kanser hücresi büyümesini bastırabildiği bir mekanizma, bu hücrelerde, kanabinoid reseptörlerinin uyarılması yoluyla hücre ölümünü uyarmak ve sonuçta programlı hücre ölümüne yol açan p8 olarak bilinen stresi düzenlenmiş proteini yeniden düzenleyerek, hücre ölümünü uyarmaktır. [513]
Δ 9 THC’nin hem insan prostat kanseri hücrelerinde hem CB1 hem de CB2’ye [514] bağlanarak ve insan meme kanseri hücrelerine bir mekanizma yoluyla bağlanarak laboratuvar ortamında hücre döngüsü durmasıyla tümör büyümesini yavaşlattığı gözlemlenmiştir; öncelikle CB2 uyarımına bağımlıdır. [515] Deri kanseri modellerinde de VEGF’de görülen benzer azalmalar, azaltılmış tümör vaskülarizasyonu ile birlikte görülmüştür. [516]
- VEGF : Kan damarlarının oluşumunu uyaran hücreler tarafından üretilen bir sinyal proteindir.
Kanabinoidlerin ilave bir etkisi, tümörlerin kan alımını azaltmak gibi görünüyor. Kanabinoide bağlı, seramid bağımlı vasküler endotelyal büyüme faktörü (VEGF) aşağı düzenlenmesi ve reseptörünün uyarılmasında azalma, gliomalarda gözlemlenmiştir. [517]
- MMP : Organojenez, büyüme ve normal doku döngüsü sırasında harici matriks proteinlerinin çoğunun bozulmasından sorumlu olan bir grup enzimdir.
Kanabinoidlerin kanser büyümesini engelleyebileceği üçüncü bir mekanizma yayılmasını sınırlamaktadır. Bu etki, glokom hücrelerinde Δ9 THC ile kanserli hücrelerin matris metaloproteazlarının (MMP’lerin) üretimini bir seramid bağımlı moda indirgeyerek görüldü. Ayrıca, Δ 9 THC’nin serviks kanseri hücrelerindeki MMP’lerin doku inhibitörlerinin ekspresyonunu arttırdığı gösterildi; laboratuvar ortamında yayılmacılığı ve göçü azalttı. [519] Δ 9 THC’nin farelerde kansr yayılmasının bastırdığı sentetik kanabinoidlerin laboratuvar ortamında akciğer [520] ve göğüs modelleri [521] için benzer etkiler ürettiği akciğer kanserinin laboratuvar ortamında modellerinde, kanser hücrelerin yayılmacılığının azalması doğrulanmıştır.
Kanabinoidler, çeşitli mekanizmalar yoluyla kanserlerin büyümesini ve yayılmasını önleyebilir: hücrelerinin ölmesine, tümörlerin kan dolaşımının azalmasına ve yayılmasının yavaşlamasına neden olur.
12.2 Beyin
Glioblastoma hücrelerinin laboratuvar ortamında bir çalışması, fizyolojik olarak ilgili konsantrasyonlarda Δ 9 THC’nin, epidermal büyüme faktörü reseptörünün (EGFR) transaktivasyonu ile MAPK / Erk ve Akt / PKB yolaklarının aktivasyonuna yol açarak kanser hücresi çoğalmasını hızlandırabileceğini gösterir. [522]
- EGFR : Epidermal büyüme faktörü ve transform büyüme faktörü a dahil spesifik ligandlarının bağlanmasıyla aktive edilen bir transmembran proteinidir.
- MAPK / Erk : Hücre yüzeyindeki bir reseptörden hücre çekirdeğindeki DNA’ya bir sinyal ileten, hücrede bulunan bir proteinler zinciridir.
- Akt / PKB : Hücre dışı sinyallere cevap olarak hayatta kalma ve büyümeyi teşvik eden bir sinyal iletim yoludur.
Şiddetli bir beyin tümörü biçimi olan glioblastoma multiforme’li 9 hastanın tümörüne doğrudan Δ9THC uygulayan pilot bir çalışma, standart tedaviyi geçemeyen, uygulamanın güvenli olduğunu ve aşikar bir psikoaktif etki görmediğini buldu. [523] Denetim grubu olmadığı ve deneme öncelikle bu yolla Δ 9 THC uygulamasının güvenliğini değerlendirmek için tasarlandığından, Δ 9 THC uygulamasının hayatta kalma süresini artırıp arttırmadığı kesin olarak söylenemez.
Medyan sağkalım süresi 24 haftadır (% 95 güven aralığı : 15-33 hafta) ve bu yazarların yazarları, habis glioma olan temozolomid için geçerli olan test tedavisine benzemektedir. [523] Bu tümörlerin biyopsilerinden laboratuvar ortamındaki çalışmalarda, Δ 9 THC’nin tümör hücresi çoğalmasını bastırdığı gösterdi. [523]
İnsanlarda kontrolsüz bir pilot çalışma, ciddi bir beyin tümörü türüne doğrudan enjekte edilen Δ 9 THC’nin, açık psikoaktif etkileri olmaksızın güvenli olduğunu bulmuştur. Çalışma kontrol edilmemişti, bu nedenle bu tedavinin etkinliği bu çalışmada değerlendirilemedi, ancak hastaların medyan sağkalım süresi 24 haftadır. Bugüne kadar oral Δ 9 THC veya Marijuana (Esrar) beyin kanseri üzerine etkileri üzerine herhangi bir çalışma yapılmamıştır.
12.3 Meme
HER2-pozitif meme kanserli bir fare modelinin laboratuvar ortamındaki çalışması, tedavi, hem tümör büyümesini hem de tümör sayısını azalttığından, 0.5 mg / gün dozunda Δ 9 THC’nin bu alt tipte etkili bir anti-tümör maddesi olabileceğini düşündürmektedir.Tümörlerdeki kan damarı sayısının kontrol ile karşılaştırıldığında azaldığı; JWH-133 olarak bilinen CB2-spesifik etkidaş benzer değişiklikleri uyardığı için, bu etki CB2 reseptörlerinin aracılık ettiği göründü. [524]
Ek olarak, 5-6.5mg / kg’lık bir dozda intratumor enjeksiyonu ile tatbik edildiğinde, kanabidiol, bağışıklık yetmezliği olan farelere enjekte edilen, yüksek oranda metastatik bir insan üçlü negatif meme kanseri (HER2, östrojen reseptörü veya progesteron reseptörü ifade etmez) olan tümör büyümesini azaltmıştır. [540]
- IL-10 / IL-4 / Th1 : Bağışıklık ve iltihaplanma protein, peptid ve hücreleridir.
Bununla birlikte, doğal olarak kanabinoid reseptörlerini ifade etmeyen bir fare meme kanser hücre hattı kullanan bir çalışmada, 9THC’ye yakın fizyolojik seviyelerin tümör büyümesini ve yaygınlığını canlılarda arttırdığını göstermiştir ; artan IL-4 ve IL-10 üretimi yoluyla tümörlere karşı immün Th1 yanıtını baskılayarak.
Bazı insan kanserleri de kanabinoid reseptörlerini eksprese etmediğinden, araştırmacılar, Δ9THC’nin, kannabinoid reseptörlerinin eksikliği nedeniyle tümörleri doğrudan baskılayamazken, hastanın bu tümörlere karşı doğal bağışıklık tepkisini de baskılayarak bu tür kanserlerde tümör büyümesini destekleyebileceğini iddia eder. 541]
Fare verileri karışık. Bazı meme kanseri türleri, Δ 9 THC ve Kannabinol tedavisine iyi yanıt verir. Bununla birlikte, diğer çalışmalar, Δ 9 THC’nin hastanın anti-tümör bağışıklık tepkisini bastırabileceğini ve bu da kanabinoid reseptörlerini ifade etmeyen bazı meme kanserlerinin alevlenmesine neden olabileceğini önermektedir.
12.4 Akciğer
Erken bir çalışma, Δ9THC ve kannabinol (ancak kannabidiol değil) de dahil olmak üzere birçok esrar bileşeninin, oral kullanım yoluyla farelerde hem laboratuar ortamında hem de canlılarda akciğer kanser büyümesini engellediği bulunmuştur. [527] Bir akciğer kanser hücre hattının daha sonraki bir laboratuvar ortamında çalışması, Δ 9 THC’nin fizyolojik açıdan önemli (nanomolar) konsantrasyonlarda, Δ 9 THC’nin daha az fizyolojik olarak etkilerini inceleyen diğer laboratuvar ortamında çalışmalara göre farklı olan kanser hücre çoğalmasını hızlandırabildiğini ortaya koymuştur. [522]
- EGF : Epidermal büyüme faktörü
- JNK : Tümörigenez ve nörodejeneratif bozukluklarda yer alan bir dizi biyolojik işlemi düzenleyen MAPK (mitojen ile aktive edilmiş protein kinaz) ailesinin bir üyesidir.
Küçük hücre olmayan akciğer kanseri (NSCLC) ‘nin laboratuar ortamında çalışmaları, Δ9THC’nin EGF kaynaklı göçü ve bu hücrelerin büyümesini, AKT ve MAP kinazlarının EGF kaynaklı fosforilasyonuna bağlı bir şekilde bastırdığını gösterir.(özellikle, ERK1 / 2 ve JNK1 / 2) [520] Bu çalışmalar, kanserli hücrelerle enjekte edilen ciddi kombine bağışıklık yetmezlik (SCID) fareler kullanan bir laboratuvar ortamında fare modelinde doğrulandı; bu fare modelinde, Δ 9 THC, tümör hücresi büyümesini ve yayılmasını bastırdı. [520]
Laboratuvar ortamındaki fare modeli çalışmaları, Δ 9 THC’nin, küçük hücre olmayan akciğer kanseri büyümesini ve yayılmasını bastırabildiğini, ancak bu etkinin insanlarda olup olmadığını veya tüm Marijuana (Esrar) bitkisini uzatıp genişletmediğini gösteren hiçbir veri olmadığını göstermektedir.
Marijuana (Esrar) kullanımı ve akciğer kanseri insidansı (anket araştırması) oranlarını değerlendirmek ve tütün kullanımını hariç tutan araştırma araştırırken, akciğer kanserine yakalanma açısından alışılmış (sık) alışılmış olan (seyrek) ya göre kullanıcılar ya da hiç kullanmayanlarda hiçbir riski yoktur. [528] Bu, başka bir yerde, tütün kontrolünden sonra hiçbir ilişkinin görülmediği, ancak dumanın solunmasından dolayı muhtemelen akciğer hasarına (katran maruziyeti, alveoler makrofaj fonksiyon bozukluğu vb.) işaret edecek olan biyobelirteçlerin not edildiğine dikkat çekmiştir.
Marijuana kullanım ve akciğer kanseri gelişimi arasındaki ilişki olmaması bir pozitif (anlamlı olmayan) eğilimine rağmen,Marijuana kullanımı ile ilgili olarak [528] solunum yollarında bazı premalign değişiklikler belirtildi. [530]
Marijuana (Esrar) kullanımı, hafif veya ağır ya tütün için kontrol edilmesinden sonra almayanlarda karşılaştırıldığında akciğer kanseri vakasında bir artış ile ilişkili gözükmemektedir. Dumanın kanserojen olduğu bilindiği için, esrar için geçerli olduğu için daha fazla çalışmayı gerektiren inhale duman nedeniyle bazı pro-karsinojenik etkiler olabilir.
12.5 Ağız ve Boğaz
Baş ve boyun kanseri hastaları arasında yapılan bir vaka kontrol çalışmasında,Marijuana içen ve hiç içmeyen ve alkol içmeyenlerle sınırlı olsa bile, esrar içiciliği ile baş veya boyun kanseri arasında istatistiksel olarak anlamlı bir ilişki bulunamamıştır.(her ikisi de bazı baş ve boyun kanserleri için ek risk faktörleridir). [546]
12.6 Prostat
Sağlıklı prostat normalde hem CB1 hem de CB2 reseptörlerinin yanı sıra esrar bileşenlerinin de hedef aldığı bilinen bazı TRPV / TRPA kanallarını ifade eder. [532] [533] Kannabinoid reseptörlerinin, LNCaP, PC3 ve DU145 gibi kanserli prostat hücrelerinde ekspresyonu, normal prostat hücrelerinde (PZ-HPV-7 ve PrEC) normalden daha yüksek görünmektedir ve bu reseptörleri, kanserli hücrelerde aktive etmenin bir doza ve hücre canlılığında zamana bağlı azalma ve reseptör antagonistleri tarafından bloke edilmiş bir şekilde programlı hücre ölümünü arttırır. [534]
Daha yüksek CB1 immünreaktivite, prostat kanserinde kötü hastalığın seyri ile ilişkili gibi görünmektedir; bunun kötüleşen durumun bir sebebi olmaktan ziyade bir sonucu olduğu düşünülmekle birlikte [550] [551]
Δ9THC, 210nM’lik bir ayrışma sabiti ile DHT bağlanmasını antagonize eden bir androjen reseptör antagonisti olabilir ve sıçan prostat dokusunda aktif olup, burada 10 mg / kg’lık bir hafta boyunca uygulandığında, testosteron enjeksiyonlarının bu dokuda DNA sentezi üzerindeki etkilerini engellediği başka bir yerde belirtilmiştir. [498] Androjen reseptöründen DHT sinyalini inhibe eden terapötik rol nedeniyle prostat kanserinde rol oynar ve esrarın bu özelliğinin yararlı olabileceği düşünülmektedir. [551]
- PSA : Semeni pıhtıda semen sıvılaştırdığı ve spermin serbestçe yüzmesini sağlayan boşalma için üretilmiştir.
Ayrıca kanserli prostat hücrelerinde, kannabinoid reseptörlerinin aktivasyonu, androjen reseptörünün protein ifadesini azaltır ve PSA’nın üretimini ve salgılanmasını azaltır, unutulmamalıdır, androjen reseptörü üzerindeki ikili etki göstermektedir.[534]
Kanabinoid reseptörleri prostat hücreleri üzerinde ifade edilir gibi görünmektedir ve bunların ifadesi, kanser sırasında artar ve kanser seyri şiddeti ile ilişkili gibi görünmektedir. Kanabinoid reseptörünü aktive etmek programlı hücre ölümüne neden olabilir ve androjen reseptörü içeriğini azaltabilir ve Δ9THC nedeniyle DHT’nin androjen reseptörüne bağlanmasını bloke edebilir. Bu henüz deneysel olarak araştırılmamış olmasına rağmen, prostat kanserinde terapötik bir rolü olabilir.
Esrarın TH 9THC dışındaki diğer bileşenleri, prostat seviyesinde ve esrarda bulunan 12 kannabinoidin değerlendirildiği bir çalışmada antikanser etkilere sahip olabilir. Kannabidiolün (CBD), prostat kanseri hücresi büyümesinin en güçlü inhibitörü olduğu ve esrar ekstraktlarının,(% 24.1-67.5 saf bileşik arasında değişen) laboratuar ortamında benzer potansiyel olma eğiliminde olduğu bulundu; kannabinoidlerin ekstraktının tükenmesi etkinliği ortadan kaldırır. [547] Bu kanabinoidler, kemoterapötikler, docetaxel ve bikalutamid ile laboratuar ortamında ilave edildi. [547]
Farelerde, CBD bakımından zengin kenevir esrarının 1-100mg / kg enjeksiyonlarının, LNCaP (androjene bağlı) hücrelerin büyümesini, 5mg / kg docetaxel’e eşdeğer bir şekilde bastırdığını ve doğal olarak DU-145 hücrelerinde etkisiz kaldığı ortaya çıktı ( androjenden bağımsız) ve docetaxel’in büyüme önleyici etkilerini arttırdı.[532] Bu bastırma etkileri yüksek olanların p53 ekspresyonuna sahip ilişkilidir ve programlı hücre ölümüne neden olan ROS üretimini artan [532] olarak bilinen östrojen reseptörü , G-proteinine bağlı estrojen reseptörü 1 (GPER) önemli ölçüde bu etkileri engellenmiş. [532]
- ROS : Reaktif oksijen türleri (ROS) oksijen içeren kimyasal olarak reaktif kimyasal türlerdir. Örnekler arasında peroksitler, süperoksit, hidroksil radikali, tekli oksijen ve alfa-oksijen bulunmaktadır.
Esrardaki diğer kannabinoidlerin, laboratuar ortamında prostat kanseri hücrelerinin programlı hücre ölümünü teşvik etmede rolü olduğu görülmektedir.
12.7 Testisler
Her ne kadar ileri analiz basit bir doz-cevap ilişkisi göstermediyse de, tanı anında 18-35 yaş arası testis germ hücreli tümör hastalarının vaka kontrol çalışması, yaş, ırk ve semte göre kontroller ile eşleşti ve esrar kullanmayanlara oranla kullananlarda rapor edilenlere göre neredeyse iki kat risk buldu ; ileri analizler sinoma olmayan ve karma histoloji tümörlerinin artmış riske en fazla katkıda bulunduğunu göstermiştir. [554]
12.8 Mesane
Yaşlı erkeklerin büyük bir kohort çalışmasında (45-69 yaş), esrar kullanımı yaş, ırk ve vücut kütlesi için ayarlama sonrasında daha düşük mesane kanseri riski ile ilişkiliydi. [555] Bununla birlikte, net bir doz-yanıt ilişkisi bulunamamıştır, ancak çalışmanın tespit edilmesi için güçlenmiş olmasına rağmen; esrar kullanıcıları kullanım süreleri boyunca kullanım sayısına göre sınıflandırıldığında, yalnızca bunu 3-10 kez kullananlar istatistiksel olarak anlamlı bir düşük tehlike oranına sahipti. [555] Esrar kullananlar arasında, hiç kullanmayanlara göre mesane kanseri riski daha düşüktü, ancak iki grup arasındaki fark istatistiksel olarak anlamlı değildi. [555]
12.9 Bağırsak ve Kolon
Standardize edilmiş yüksek kannabidiolün (ekstrenin ağırlıkça% 65.9’u) esrar ekstraktının, normal hücre büyümesini etkilemeden CB1 ve CB2’ye bağlı bir şekilde 3-5μM konsantrasyonlarında laboratuar ortamında kolorektal kanser seviyesini azalttığı gösterilmiştir; kolon kanserinin bir ksenograft fare modeli, 7 gün boyunca karıniçi enjeksiyon yoluyla 5 mg / kg ekstraktın uygulanmasıyla tümör büyümesinde bir azalma gösterdi. [556]
12.10 İmmünolojik Kanserler
Bazı fare tümör immün kökenli tipleri, 1-20μM konsantrasyonlarında laboratuar ortamında Δ9THC’ye karşı hassastır, bu da kanser hücresi canlılığını azaltır ve bu hücrelerde programlı hücre ölümünü arttırır. [557] Δ9THC, canlılarda, 5 mg / kg konsantrasyonunda karıniçi enjeksiyonlar verilen lenfomalı farelerde etkili oldu, tümör yükünü azalttığı gibi hayatta kalma oranlarını da arttırdı. [557]
12.11 Destek Olarak Kullanımı
Esrar kemoterapiyle ilişkili ağrının tedavisinde kullanımına yönelik araştırmalara rağmen araştırmalar halen düşük kalitede (GRADE yaklaşımına dayanarak) olma eğilimindedir ve genel olarak kronik ağrı içinde yapılmaktadır. [545] Toplam 809 hastayı kapsayan 18 çalışmanın değerlendirmesinde, Marijuana veya oral Δ9THC kullanımının, psikoaktif etkilerin yanı sıra -0.61 (-0.84 ila -0.37% 95 güven aralığı ) ile standartlaştırılmış ortalama farkı (SMD) ile kronik ağrı yoğunluğunda önemli bir azalma ile ilişkili olduğu belirtildi.
Esrar zaman zaman kemoterapiyle ilişkili ağrıyı azaltmak için kullanılsa da, bu kullanım için spesifik kanıtlar görünmemektedir. Kemoterapi sırasında ağrıya uzanabilir genel olarak kronik ağrı Marijuana yararları için bir kanıt yoktur.Esrarın genel olarak kronik ağrıda, kemoterapi sırasında ağrıya neden olabilecek faydaları olduğuna dair kanıtlar vardır.
Esrarın kemoterapide iştah açıcı etkilerinden dolayı destek olarak kullanıldığı bildirilmiştir, çünkü düşük gıda alımından kaynaklanan kilo kaybı bazı kanserlerin hastalık seyrini kötüleştirebilir ve kilo kaybını azaltmaya yönelik herhangi bir girişim koruyucu olarak görülse de bu özel kullanım nispeten seyrektir. [558]
Kemoterapi sırasında kilo kaybını önlemek terapötik bir hedeftir, çünkü Marijuana iştah uyarıcı özellikleri de, bir yardımcı madde olarak, kanser tedavisi için faydalı olabilir. Esrarın destek olarak kullanımını desteklemek için bazı kanıtlar mevcut olsa da, daha fazlasına ihtiyaç vardır.
13 Uzun Ömürlülük ve Yaşam Uzatma
13.1 Gerekçe
Endokanabinoid sistem, gıda ve iştah düzenlenmesinde görev alır [547] ve dahili N- acylethanolamines (Nae) (endokanabinoid sistemi aktive sinyal molekülleri) azaltarak nematod modelinde diyet kısıtlaması altında ömrü artırmak rol oynadığı gösterilmiştir. [548] Yapay olarak artan enzim seviyeleri NAE’leri parçalayan bir enzim olan Yağ Asidi Amid Hidrolaz, diyet kısıtlamasının ömrünü uzatan etkilerini taklit ederken, belirli bir NAE’yi takviye ederek bu etkileri ortadan kaldırır, NAE’lerin uzun ömürlülükte rol oynadığı fikrine nematodlarda (bir çeşit kurtçuk) daha fazla destek verir.. [563]
- ALS : Esas olarak, kas hareketini kontrol etmekle sorumlu sinir hücrelerini (nöronları) içeren bir grup nadir nörolojik hastalıktır.
- Süperoksit dismutaz : Süperoksit radikalinin değişimini sıradan moleküler oksijen veya hidrojen perokside dönüşümlü olarak katalize eden bir enzimdir.
Amiyotrofik lateral sklerozu (ALS) modellemek için mutasyona uğramış bir süperoksit dismutaz genine sahip transgenik farelerde, FAAH enziminin kaldırılmasının, bir anandamide’de bir artış olmasına rağmen, yaşam süresini değiştiremediği, ancak CB1 reseptörünün hayat süresini arttırdığı belirtilmiştir [564].
Diyet kısıtlama ömrünü artırmak için bir solucan modelinde gösterilmiştir ve Endokannabinoid sistem burada bir rol oynadığı görülmektedir. Endokannabinoid sistemi de ALS bir fare modelinde uzun ömür için bir rol oynar.
14 Cinsiyet ve Gebelik
14.1 Doğurganlık
3-6mg / kg vücut ağırlığındaki sıvı (sulu Esrar Sativa) oral alım Bhang, sıçanlarda testis ağırlığını 36 gün boyunca, 3mg / kg’da% 17 ve 6mg / kg’da% 33 azaltabilir. [4]
14.2 Sperm Oluşumu
Histolojik olarak, gözlenen sperm tübüllerin % 40’ına kadar 3-6mg / kg Bhang alımının oral yolla uygulanmasından sonra sperm oluşumunda bulunmadığı görülmüştür. [4] Sperm programlı hücre ölümü (sperm ölümü) boyama ile gözlemlenen artış eğilimi gösterdi. [4]
15 Diğer Tıbbi Koşullar
15.1 Alzheimer Hastalığı
Alzheimer hastalığı biyokimyasal bir seviyede, çoğunlukla β-amiloid ve genellikle tau olarak bilinen bir protein içeren ‘yumaklar’ oluşan plakların bir birikimi ile karakterize edilir, bir nörodejeneratif hastalıktır. [550] Bu plaklar ve dolaşmaların etrafındaki nöro-iltihaplanma, nöroglial hücrelerin iltihaplanma aktivasyonu olarak, kritik bir ara madde ile nöronal hasar ile ilişkilidir.
- β-amiloid : Alzheimer hastalarının beyinlerinde bulunan amiloid plakların ana bileşeni olarak Alzheimer hastalığında çok önemli rol oynayan 36-43 amino asitten oluşan peptidleri ifade eder.
[553] Bu reseptörün bir eksikliği amiloid patolojisi ağırlaştırmaktadır çünkü kannabinoid sistemi, özellikle, CB2 (anti-iltihaplanma ancak psikoaktif etkilere aracılık reseptörü), bu patoloji ile ilgili gibi [554] ve sistemin aktivasyonu patolojisi ters görünmektedir. [555]
CB2 reseptörü, CB2 reseptörünü ve CNR2’yi eksprese eden genin mikroglia dahil çeşitli immün hücrelerinde eksprese edilir, ve transkripsiyonu, Alzheimer hastalığı sırasında, bilişsel bozulma ile ilişkili olan kontrole göre daha fazla düzenlenmiş olabilir, bu da dahili kannabinoid aktivitesinde bir düşüşün yanı sıra daha fazla CB2 reseptörü ile sonuçlanır ; anandaminde gibi dahili kanabinoidleri parçalayan bir enzim olan Yağ Asidi Amid Hidrolaz’ın düzenlenmesi nedeniyle olduğu düşünülmektedir. [576]
Alzheimer hastalığında endokannabinoid sisteminde düzensizlik var gibi görünüyor. Bunun bir yönü, en azından kısmen, onları parçalayan bir enzim olan FAAH’nın yukarı düzenlenmesinden dolayı endokannabinoid aktivitede bir azalmadır. Ayrıca, CB2 reseptörleri, Alzheimer hastalığına yakalanmış beyin dokusunda aşırı eksprese edilir.
Aβ 1-40 (amiloid beta) fibrillerlerin, süpürücü reseptör A, CD36, α6β1 integrin, CD47 ve TLR’ler gibi yüzey reseptörlerine etki ederek nöronların yakınlarında lokalize olan mikroglial bağışıklık hücrelerini aktive ettiği bilinmektedir. [562] [564] [565] CB2 laboratuvar ortamında aktifleştirildiğinde bu genel işlem engellenir. [566]
Alzheimer patolojisini taklit etmek için Aβ 1-40 fibrilleri enjekte edilen farelerde, CB2’nin (sentetik kanabinoid MDA7 [567] yoluyla aktivasyon) bellekle kontrolün göreceli olarak yakın hafızasını korumaktadır; bunun nedeni, Hippokampal CA bölgesinde azaltılmış mikroglial aktivasyona bağlı olduğu düşünülmektedir. [555]
Ayrıca, CB2 aktivasyonunun, hipokampal CA1 bölgesinde Aβ 1-40 klirensini de arttırdığı gözlemlendi. [555] MDA7 ile tedavi, bu bölgedeki CB2 reseptör yukarı düzenlenmesi veya glutaminerjik sinyal bozukluğu gibi anormallikleri de önledi. [555] Enjekte edilen Ap’nin toksik etkileri, kemirgenlerdeki diğer çeşitli kanabinoidler tarafından azaltılmıştır. [581]
CB2’nin çeşitli kanabinoidlerle aktivasyonu, kemirgen modellerde uyarılan Alzheimer hastalığının yan etkilerinin çoğunu azalttığı görülmüştür.
15.2 Multipl Skleroz
Marijuana (Esrar), multipl skleroz ile ilişkili birçok fiziksel ve ağrı belirtilerini geliştirdiği kendi kendine raporlamaya göre kısmen multipl sklerozun (MS) tedavisi için araştırılmıştır. [568] Hollanda gibi tıbbi Marijuana reçetesi verilen yerlerde, multipl skleroz, Marijuana (Esrar) için daha yaygın kullanılan tıbbi kullanımlardan biridir. [569] Multipl skleroz muhtemel faydalılığına ilişkin bazı kanıtlar da hayvan verilerinden gelmektedir. Farelerde, multipl skleroze yararlı olabilecek bir şekilde bağışıklık tepkisini modüle etmek için kanabinoidler gösterilmiştir. [570]
Multipl sklerozde Marijuana (Esrar) tedavisinin genel etkinliği açısından, Amerikan Nöroloji Akademisi tarafından günümüze kadar elde edilen kanıtların sistematik olarak gözden geçirilmesi, oral Marijuana (Esrar) özünün multipl skleroz’de spastisite ve merkezi ağrı veya ağrılı spazmları azaltmada etkili olduğunu bulmuştur.Füme Marijuana , önceki belirtilerin her ikisinde belirsiz etkiliydi ve genel olarak Marijuana multipl skleroz’un diğer semptomları için muhtemelen etkisizdir. [571]
Kanıtların sistematik bir şekilde incelenmesine göre, oral Marijuana özü multipl skleroz’de ağrı ve spazmları azaltmada muhtemelen etkilidir, ancak tütsülenmiş marijanın herhangi bir belirti için etkinliğini destekleyecek daha az kanıtları vardır.
Multipl skleroz için oral Marijuana (Esrar) özütünün etkilerini incelemek için klinik çalışmalar yapılmıştır. [572] Hastaya rapor edilmiş olmasına rağmen, Ashworth ölçeğini kullanan bir doktor / fizyoterapi tarafından rapor edildiği gibi, 15 haftadan fazla multipl skleroz olan birinde Marijuana (Esrar) özünün veya saf Δ 9 THC’nin (ağırlık bazında 25 mg’a kadar) oral yoldan tüketimi fiziksel hareketliliği artıramadı. Spastisite ve ağrı plaseboya kıyasla önemli ölçüde azaldı ve uykuda ikincil gelişmeler kaydedildi (yorgunluk veya ruh hali değişmedi). [572]
Bununla birlikte, bu çalışma (CAMS çalışması) bir yıl sonra takip edildi ve tedaviyi sürdürmeyi seçenler arasında, Ashworth ölçeği ile değerlendirdiği gibi küçük bir terapötik etki ve spastisite ve ağrının kendi kendine bildirdiği faydalar ve hiçbir büyük güvenlik kaygısı olmaksızın kaydedildi.
Multipl skleroz hastalarında oral kannabis sativa (başka bir deyişle 25 mg Δ 9 THC’ye kadar titrasyon yapmak için kullanılan iki hafta) verilen diğer bir büyük araştırmada (MUSEC), kas sertliğinde önemli azalmalar bildiren hastaların yüzdesinin % 29.4’e ulaştığını belirtti. Marijuana (Esrar), plaseboya sadece% 15.7’ye ulaşmasına rağmen, 2.26’lık yararlı etkiler için olasılık oranı sağlamıştır. [574]
Oral kanabis ekstraktı veya oral Δ 9 THC’nin klinik denemeleri, günlük kullanımın, MS ile bağlantılı kendini bildirilen ağrı, spastisite ve sertliği azaltabileceğini buldu.
Marijuana’nın multipl skleroz hastaları üzerindeki bilişsel etkileri de incelenmiştir. Esrar sigara içen (çoğunlukla günlük) bildiren multipl skleroz olan kişilerde, en az 12 saat boyunca bırakmanın ardından, esrar içme grubu, esrar kullanmayanlara göre kısa süreli hatırlama ve çalışma hafızası testlerinde daha kötü performans göstermektedir;[348] Yorgunluk ve depresyon gruplar arasında farklılık göstermedi. [348]
Çalışma belleği ve sürekli dikkat için bir Sembol Sayı Modaliteleri Testi (SDMT) üzerinde daha yavaş performans gösteren sokak Marijuana’sı kullanan 10 kişi üzerinde yapılan bir çalışmada benzer negatif ilişkiler kaydedildi (Multipl skleroz için Nöropsikolojik Pil üzerinde hiçbir fark bulunmamakla birlikte, veya NPBMS) ; [575] ve multipl skleroz olan 25 esrar kullanan kişilerin bilgi işleme, çalışma hafızası ve yürütme işlevi hakkındaki hastalık kontrollerinden daha kötü performans gösterdiği kesitsel bir çalışmada.
Plasebo kontrollü çalışmalara bakıldığında,(Yukarıda belirtilen çalışmalar ilişkiler) farklı zamanlarda sekiz hafta boyunca Esrar sativa alan (kas spastisitesini azaltmak için kişisel olarak optimal doza titre edilir) multipl skleroz olan kişiler, plaseboya kıyasla eski ile hafıza kaybı yaşamamışlardır. [592]
Esrar kullanımının, multipl skleroz olan hastalara göre, ancak rapor edilmiş esrar kullanımına sahip olmayan, multipl sklerozlu kişilerde kullanımı, bozulmuş çalışma hafızası ve düşük yürütme işlevine dikkat çeken en az bir çalışma ile kısa süreli hatırlama ile ilişkili görünmektedir. Marijuana (Esrar) içeren bir çift kör kontrollü çalışma, küçük olsa da, bu gözlemleri çoğaltamadı.
Daha az bildirilmekle birlikte, esrar kullanımı multipl skleroz olan kişilerde idrar kaçırma konusunda ve büyük bir çalışmanın alt çalışmasında (CAMS çalışması) kendinden bildirilen gelişmelerle ilişkili görünmektedir. İdrarı tutamamada (özellikle acil durum idrarını tutamama) önemli gelişmeler bildiren plasebodaki deneklerin% 18’inin, her ikisi de on beş hafta boyunca 25 mg Δ9THC eşdeğerinde dozajlanan hem Esrar sativa kapsülleri hem de saf Δ9THC (% 33-38) ile daha iyi performans gösterdiği kaydedilmiştir. [593][578]
Ana CAMS denemesinin altta yatan tedaviden farklı olarak mesane semptomu üzerinde herhangi bir etki bulamadığı belirtilmelidir, [572] ancak yine de daha fazla kanıt gerektiren gelmekte olan bir tedavi seçeneği olarak düşünülmektedir. [579]
Sınırlı kanıtlara dayanarak, multipl sklerozda görülen idrarı tutamama yan etkisinin, özellikle de marijauna kapsülleri veya Δ9THC kullanılmasından faydalı şekilde etkilenebileceği görülmektedir.
15.3 Amyotrofik Lateral Skleroz
Amyotrofik Lateral Skleroz (ALS), glial hücrelerin rol oynayabileceği ilerleyici bir nörolojik bozukluk olup, insan otopsi kanıtları, bu bozuklukta omurilik hasarının CB2-pozitif mikroglial aktivite ile ilişkili olduğunu ve kanabinoidlerin teoride etkileyebileceğini düşündürmektedir. [580] Bu olasılık, semptomların başlamasından önce ya da başlangıcında uygulanan Δ 9 THC’nin iyileştirilmiş semptomlarının bir fare modelinde desteklenmiştir. [581]
Marijuana’nın, ALS’nin tedavisinde ve hafifletilmesinde yararlı olabilecek etkileri olduğu belirtilmektedir. [582] ALS’li diğer kişilere yapılan bir araştırmada, iştah kaybı, depresyon, ağrı, spastisite ve ağız sulanması gibi kendiliğinden raporlar ortaya çıkmış ancak diğer ALS semptomları da etkilenmedi ve örneklem boyutu çok küçüktür. [583]
Hayvan verileri, kanabinoid sistemin ALS’nin hastalık ilerlemesine karışabileceğini ve bu modellerde Δ 9 THC’nin ilerlemeyi geciktireceğini düşündürmektedir. ALS hastaları, Marijuana (Esrar) kullanan bazı ALS semptomlarından kurtulmayı bildirdiler, ancak bugüne kadar bu iddiaları desteklemek için Marijuana’nın veya bileşenlerinin etkisini değerlendirmek için herhangi bir klinik çalışma yapılmamıştır.
15.4 Parkinson Hastalığı
Esrar, tarihsel olarak titremeyle ilişkili Parkinson hastalığı olan hastalara verilirken, sabahları % 2-9’luk THC içeriği olan 1 g esrar içeren 5 Parkinson hastasını tedavi eden küçük bir pilot çalışma, öznel rahatlama veya titreme ciddiyetinde hiçbir fayda sağlamadı. Parkinson hastalarının denemesinde levodopa kaynaklı diskinezi hafifletmek için oral Marijuana (Esrar) özütü kullanan küçük, çift kör çapraz çalışma, diskinezi veya Parkinson hastalığının semptomlarında hiçbir ilerleme bulmadı. [585]
Bununla birlikte, Parkinson hastalarında sigara içilen Marijuana’nın açık etiketli bir çalışması, titreme azalması da dahil olmak üzere, kullanım sonrası hastalarda Birleştirilmiş Parkinson Hastalık Değerlendirme Ölçeğinde (UPDRS) belirgin bir düşüş görmüştür. [586]
Buna rağmen, Prag’daki Parkinson hastaları ile ilgili daha büyük bir araştırma, esrar kullanan hastaların neredeyse yarısının, esrarın belirtilerinin genel olarak% 30 ile düzeldiğini bildirdiğini belirttiğini bildirdi. [602]
Parkinson hastalığında Marijuana (Esrar) maddesinin etkinliği ile ilgili kanıt şu anda karışık; bazen hastalar sübjektif semptomların hafifletildiğini rapor ederken, bazı araştırmalar etkisinin çok azını buldu.
Parkinson hastalığında ve sabit Parkinson tedavisi dozunda altı veya altı haftalık süre boyunca 75 veya 300 mg / gün Kannabinol kullanan küçük çaplı çift kör bir çalışma, UPDRS skoru ile semptomlarda herhangi bir değişiklik bulamadı; ancak yaşam kalitesinde bazı iyileşmeler oldu 300 mg doz grubunda Parkinson Hastalığı Anketi (PDQ-39) tarafından rapor edildi. [588]
15.5 Psikoz
Marijuana (Esrar) kullanımının rekreasyonel olarak kullanımı, çeşitli zihinsel hastalık biçimleri, özellikle psikoz ile tutarlı bir şekilde ilişkilidir, [589] ancak nedensel bir ilişki olup olmadığı tamamen açık değildir.Bazı gözden geçirmeler, esrar için, “esrar psikozuna” neden olmak yerine mevcut şizofreniyi şiddetlendiren daha fazla kanıt bulunduğunu iddia ederken, diğerleri nedensellik önermektedir. [590] [591]
Günümüze kadar elde edilen kanıtlar artan Marijuana (Esrar) kullanımının, önceden varolan psikotik belirtilerin kendinden ilaçlanması girişimlerine atfedilebileceği hipotezini dışlamaktadır. [592] [593] Ayrıca, genetik katkı küçük olmasına rağmen, insanları Marijuana (Esrar) kullanımına ve şizofreniye yatkın hale getirebilecek ortak bir genetik bileşen olabileceği de düşünülmektedir. [594]
Durum kontrol çalışmaları yanlılığı hatırlamaya yatkın olabileceğinden ve tıbbi esrar kullanımının randomize kontrollü denemeleri ilacı rekreasyonel kullanan popülasyonlara uygulanamayacağından, esrar kullanımı ile psikoz belirtileri arasındaki nedensel bağlantı için en iyi kanıt boylamsal kohort çalışmaları olacaktır.
Bu tür birkaç çalışma yapıldı ve esrar kullanımı ile psikotik semptomların gelişimi arasında bir bağlantı olduğu görülüyor. İsveçli bir erkek kohortunun büyük bir erkek kohortunu inceleyen bu tür bir çalışmanın izlenmesi, başka yasadışı madde kullanmadan esrar kullananlarda şizofreni gelişme riskinde doza bağlı bir artış buldu (tahmin oranı 1.9,% 95 güven aralığı 1.1-3.1).
Esrar kullanıcılarında herhangi bir psikotik semptomun gelişmesi için böyle bir doza bağlı ilişki, birden fazla karıştırıcılar ayarlandığında, 3 yıl boyunca genel popülasyondan bir Hollandalı örnekte de bulundu ( OR 2.76,% 95 CI 1.18-6.74). Yeni Zelanda örneği ayrıca, esrar kullanımından önceki semptomları dikkate alarak, esrar kullanımına ve diğer kafa karıştırıcılara neden olan önceden var olan psikotik semptomları göz ardı etmiş olsa da, marijauna kullanımı ile psikotik semptom gelişimi arasında doza bağımlılıkla pozitif bir ilişki göstermiştir. [613]
Farklı bir örnek kullanarak yapılan ayrı bir Yeni Zelanda çalışması, esrar kullananlarda ilk şizofreni semptomları riskinin arttığını ve ilk kullanım yaşının erken olması durumun kötüleşmesi riskine yol açtığını doğruladı. [614] Son olarak, 10 yıldan fazla ergenlerde esrar kullanımına ilişkin bir Alman kohort çalışması, diğer psikiyatrik tanıları içeren diğer değişkenler de dikkate alındıktan sonra bile esrar kullanımı ile psikotik belirtiler arasında bir bağlantı olduğunu doğrulamıştır ; Bu çalışma ayrıca, kendi kendine ilaç hipotezinin, esrar kullanımından önceki psikotik semptomların gelecekteki esrar kullanımını öngörmediğinden olası olmadığını belirtti. [615]
Buna ek olarak, ergenlik döneminde Marijuana’ya erken maruz kalma, daha sonra hayatta psikoz gelişimiyle ilişkili görünmektedir. [601] Araştırmacılar tarafından yapılan bir araştırmada, 14 yaşından önce Marijuana (Esrar) kullanımının, yetişkinlikte şizotipal kişilik bozukluğunun (SPD) semptomların çoğul karıştırıcılar için ayarlandıktan sonra bile gelişmesini öngördüğü saptanmıştır. Bununla birlikte, ergenlik döneminde SPD semptomları olanlarda Marijuana (Esrar) kullanımı yetişkinlikte semptomları etkilemekte gibi görünmemektedir. [602]
Buna ek olarak, rastgele seçilmiş 4-16 yaş grubu bir gruptan başlayarak Hollanda’da 14 yıllık prospektif bir çalışma, Çocuk tarafından değerlendirildiğinde psikotik belirtilerin başlangıçta psikolojik belirtilerin olup olmadığına bakılmaksızın Marijuana (Esrar) kullanımı ile ilişkili olduğunu tespit etmiştir. Bu çalışmanın yazarları, esrar kullanımının kendi kendine raporla değerlendirilmesine rağmen, bu raporların Hollanda’da yasal statü ve esrar kullanımının bu kültürde göreceli olarak kabul edilebilirliği nedeniyle daha muhtemel olduğuna dikkat çekmektedir. [618]
Pratik ve etik kaygılar nedeniyle uzun süreli kontrollü bir esrar kullanımı denemesi yapılmamasına rağmen, damariçi olarak aşılanmış Δ9THC’nin plasebo kontrollü çalışmaları ve bunun bazı psikotik semptomlar üzerindeki etkileri olmuştur. Bir çalışmada, hem marijauna hem de marijauna kullanıcılarının 20 dakikanın üzerinde bir denemesinde esrar kullanımı sırasında elde edilen Δ9THC kan seviyelerini taklit etmek için 20 dakika boyunca uygulanan 2 mg / mL’lik bir infüzyon, hem Pozitif hem de Negatif Sendrom Ölçeğinde (PANSS) bir artış olduğunu göstermiştir.
Psikozun, plaseboya göre, ancak “panik” veya “endişeli” görsel derecelendirme ölçeklerinde bir değişiklik olmaması; İnfüzyonun subjektif deneyiminin rekreasyon esrar kullanımınınkine benzer olduğu bildirilmiştir. [619] Antipsikotiklerle tedavi edilen stabilize şizofreniklerde yapılan benzer bir deney, pozitif ve negatif psikotik semptomlarda anlamlı bir geçici artış göstermiştir. [620]
Geçtiğimiz ay en az bir paranoyak düşüncesi olan ve gerçekçi bir sanal gerçeklik simülasyonu ile paranoyayı değerlendiren ve paranoyaya hangi konjuge bileşenlerin katkıda bulunduğuna odaklanan bireylerde IV ile aşılanmış Δ9THC kullanan başka bir plasebo kontrollü çalışma; Olumsuz etkiler ve düşünce yankıları, halüsinasyonlar ve duyusal deneyimlerdeki olağandışı değişiklikler gibi anormal deneyimlerdeki bir artışın olduğunu bulmuşlardır. [621]
Bazı gözlemsel çalışmalar, marijauna kullanımının, özellikle genç yaşta, daha sonra yaşamda psikotik semptom geliştirme riskindeki bir artışla ilişkili olabileceğini göstermiştir, ve kısa süreli plasebo kontrollü çalışmalar, Δ9THC’nin hem sağlıklı hem de şizofrenik bireylerde psikotik semptomları kısaca arttırabileceğini doğrulamıştır. Ancak, bu ilişki nedensellik göstermez, dikkat etmek önemlidir ve daha araştırma kesin bir bağlantı kurmak için gereklidir. Kanıtların vücut nedensellik doğru eğilir rağmen, bu psikoza yatkın bazı popülasyonlarda ortaya çıkabilir olmadığını şu anda açık değildir.
Psikoz mekanizmaları tamamen net olmasa da bu Marijuana (Esrar) psikoz ve şizofreni belirtilerinin gelişiminde nedensel bir role sahip olabilir. Genel varsayımsal nedensellik modu, THC’nin, beyin korteksinin ön bölgeleri, bazal ganglionlar, hipokampus, serebellum ve anterior cingulate korteks gibi psikozda ortaya çıkan beyin bölgelerinde dağıtılan CB1 reseptörleri üzerindeki etkilerini içerir. [607] [608]
CB1 reseptörünün birincil genel rolü presinaptik THC psikolojik etkilere neden olabilecek genel mekanizma ileri süren uyarıldıktan sonra sinir iletimi salımını düzenlemektir. [607] Özellikle, THC’nin, beynin striatal ve mezokortikoimbik alanlarındaki dopamenerjik aktivitesini arttırdığı, bunun da esrar kullanımının, artan dopaminerjik aktiviteye bağlı olduğu düşünülen bazı pozitif psikoz semptomlarına neden olabileceğini açıklayabildiği görülmüştür.
THC psikotik semptomlar uyarabilir hangi bir ikinci mekanizma glutamat aktivitesini azaltarak aracılığıyla olabilir. 1980 yılından itibaren, hipoglutamaterjik (indirgenmiş glutamat) sinir iletimini, şizofreni ile ima edilmiştir; bağlı NMDA reseptörünün azalmış etkinliğe özellikle. [609] [610] Esrarda bulunan Δ9THC içeriği, daha sonra NMDA glutamat reseptörüne bağlanan ve kısa süreli olarak NMDA yoluyla sinyalleşmeyi azaltan CB1 reseptörünü aktive ederek NMDA reseptörü aktivitesini de azaltabilir.[192]
Kannabinoidlerin sitozol içine NMDA reseptörleri birlikte içselleştirebilirler CB1 reseptörlerinin, ko-içselleştirme yoluyla yapabilir. [193] Buna ek olarak, subkronik uygulama arasında Δ 9THC, NMDA reseptörlerinin, ekspresyonunu (hayvan modellerinde) hipokampus NR1 ve NR2 alt birimleri azaltmak için görülmüştür. [184]
Son olarak, bazı genç kullanıcılarda psikozun ortaya çıkmasında arabuluculuk yapmak için esrar kullanan ergenler için önceden belirlenmiş bir genetik arabulucu var gibi görünmektedir; Özellikle, uzunlamasına bir çalışma, gençken esrar kullanan şizofreniform bozukluğu geliştirme olasılığı daha yüksek olan katekol-O-metiltransferaz (COMT) geninin bir türünün taşıyıcılarının (valin-158 alel) olduğunu göstermiştir. [611]
Bu varyantın taşıyıcıları dopamini daha hızlı katabolize eder, prefrontal kortekste dopamin aktivitesinin azalmasına neden olur; bu durum, striatal dopaminerjik aktivitede artmış disregülasyona ve dolaylı artışa ve artmış pozitif psikotik semptomlara yol açabilir. [628]
Esrarın psikotik semptomlara neden olabileceği biyolojik olarak kabul edilebilir. Bunu yapabildiği mekanizmalar dopamin ve glutamat sistemlerini içerebilir.
Yukarıda tartışılan psikoz semptomlarının Δ9THC’nın etkisine bağlı olduğundan şüphelenilse de, CBD’nin davranışlarının bazı anti-psikotik özelliklere sahip olduğu yönünün tersi yönde hareket ettiği görünmektedir. [631] Bu etkiler gerçek hayatta esrar kullanımına yol açabilir; bir grup, CBD içeriği daha yüksek olan marijauna kullanımının psikotik semptomların daha düşük görülmesi ile ilişkili olduğunu bulmuştur. [632]
Bir başka çalışma, saç örneklerinde Δ9THC bulunan deneklerin, saçlarında Δ9THC ve CBD bulunanlara ya da bulunmayanlara göre daha yüksek psikotik semptom insidansına sahip olduğunu buldu. [633] Ayrıca, psikozun ilk bölümünü sergileyen bir vaka kontrol çalışması, vakaların, Δ9THC içeriğine ve düşük CBD içeriğine sahip yüksek potensli esrar kullanma eğiliminde olduklarını, hash (reçine) tercih etme eğiliminde olan kontrollerden daha fazla kullandıklarını tespit etti, bu daha yüksek CBD-Δ9THC oranına sahiptir. [634]
Esrarın CBD ile Δ9THC arasında değişen oranları vardır; Hollanda kahve dükkanlarında satılanlar, bitkisel marijauna için tipik olarak yaklaşık 0.01 ila Δ9THC, reçine için ise 0.44’tür. İngiltere’de bulunanlar bitki için 0,05, reçine için 1,2 olan CBD / Δ9THC oranına sahiptir. [635]
CBD, anti-psikotik etkilere sahip olabilir. Esrarda CBD’nin 9THC’ye oranının, kullanıldığında psikoz semptomları gelişme olasılığı ile ilişkili olduğunu gösteren bazı kanıtlar vardır.
15.6 Cinnet
Prospektif kohort çalışmalarının literatürünün sistematik bir derlemesi ve meta-analizi, psikotik bozukluğu olmayanlarda kronik esrar kullanımının manik semptomlarla ilişkili olup olmadığını incelemiştir; Dahil etme kriterlerini karşılayan 6 çalışma bulundu ve meta-analiz için 2 çalışma birleştirildi. [636] Çalışmaların üçünde, önceden var olan bipolar bozukluğu olan katılımcılar ve sistematik derlemenin yazarları, esrar kullanımının, manik evreyi uygulayarak bipolar bozukluk seyrini daha da kötüleştirebileceği sonucuna varmıştır. [636]
Yazarlar ayrıca, esrar kullanımının, bipolar bozukluğun ya da manik semptomların gelişimi ile ilişkili olduğu önceden varolan bozukluğu olmayanların üç prospektif çalışmasından sonuçlanmıştır, ancak ikinci durumda, manik semptomlar bazen klinik eşiğin altında kalmıştır ve Bu bulgunun klinik önemi tamamen açık değildir. [636]
Klinik bozukluğu olmayan çalışmalara girenlerde yapılan çalışmaların ikisinin meta-analizi, esrar kullananlarda 2.7 (95% güven aralığı 1.80-4.90) olan ve düşük heterojenliği olanlarda manik semptomlar geliştirmek için olasılık oranını buldu. [636] Yazarların bulduğu prospektif çalışmaların sayısının azlığı, eserler arasında esrar kullanımının değerlendirilmesindeki değişkenlik, dahil edilen çalışmaların çoğunda önyargı potansiyeli ve dahil edilen çalışmaların gözlemsel niteliği dahil olmak üzere sistematik derlemede bazı sınırlamalar vardı ki bu ispat nedenselliğini önler. [636]
Marijuana kullanımı, nedensel olup olmadığı, hem de bu bulgunun kesin klinik önemi olmakla birlikte, bipolar bozukluğu olan ve olmayan kişilerde artmış manik belirtilerle ilişkilidir.
15.7 İltihaplı Bağırsak Hastalığı
İltihaplı Bağırsak hastalığı olan kişilerin anketinde, esrar kullananların (Numunenin% 17,6’sı, neredeyse tamamen solunum yoluyla) esrar kullanımının karın ağrısı ve eklem ağrısında ve ishalin iyileştirilmesine dair yarı raporlar ile kramplanmada eşlik ettiği belirtilmiştir ; Her ne kadar altı ay boyunca esrar kullanımı Crohn hastalığı olanların ameliyat gerektirdiğini öngörüyorsada.(% 95 güven aralığı , olasılık oranı 1.45-17.46)
Özellikle Crohn hastalığı olan hastalarda yapılan bir başka retrospektif gözlem çalışması, bildirilen semptomlarda iyileşme buldu; Harvey-Bradshaw endeksinde anlamlı bir azalma, hastalarda kullanmadan önce esrar kullanımına başladıktan sonra görüldü. [644] Küçük olası izler de bazı faydalar göstermiştir. 13 kişiden oluşan kontrolsüz bir pilot çalışma, İltihaplı Bağırsak hastalığının esrar alan hastalarda kendi bildirdiği düzelme göstermiş, bazı refah alanlarında belirgin iyileşmeler ve Harvey-Bradshaw endeksinde bir azalma olduğunu göstermiştir. [645]
Ek olarak, Crohn’un günde iki kez 115mg-9THC (THC’nin çıkartıldığı plasebo ile) içeren esrar sigarası uygulayan hastalarında yapılan küçük plasebo kontrollü bir çalışma, tam hafiflemesinin birincil son noktasına ulaşılmamasına rağmen, tedavi grubunda önemli bir klinik yanıt buldu. [646]
Ayrıca kontrolsüz bir çalışma, İltihaplı Bağırsak hastaların esrar kullanırken semptomlardan kurtulduğunu bildirmiş, ancak bu ilişki nedensel olmasa da, Crohn’un 6 ay veya daha uzun süre esrar kullanan hastaların cerrahi müdahale (olasılık oranı 5.03,% 95 güven aralığı 1.45-17.46) oranının daha yüksek olduğunu tespit etmiştir. [643]
Ön kanıtlar bugüne kadar elde edilen bulgular sadece gözlemsel veriler ya da çok küçük çalışmalar biçiminde olmasına rağmen Marijuana (Esrar) İltihaplı Bağırsak hastalığı semptomlarını iyileştirmeye yardımcı olabileceğini göstermektedir.
16 Besin-Supplement Etkileşimleri
16.1 Alkol
Alkol, Marijuana (Esrar) yanında yaygın olarak kullanılan bir ilaçtır ve her ikisinin de birbirleriyle etkileşim halinde olduğu bilinmektedir.
Alkolün dopamin salıcı etkileri CB1 reseptörüne bağımlıdır (engelleme, alkolün yol açtığı dopamin aktivitesini azaltabilir) ve bu reseptörün bloke edilmesi, çeşitli kemirgen türlerinde gönüllü alkol alımını azalttığı kaydedilmiştir. [632] [633] 634] [635] [636] Muhtemelen dopamin’in alkol arama davranışlarında motivasyonel etkilere karışması nedeniyle CB1’in dopamin salınımı üzerindeki baskılanması etkisinden dolayıdır. [637]
Farelerdeki dopamin salınımı üzerindeki etkileri CB1 reseptörlerinin aktivasyonuna bağlı gibi görünmektedir, çünkü bloke etmek, akumbens çekirdeğindeki alkolün neden olduğu dopamin salınımını ve bundan sonra da farelerde alkolün kendiliğinden uygulanmasını azaltabilir.
16.2 Kafein
Kafeine toleransın, birkaç beyin bölgesindeki adenosin A1 reseptörlerinin yoğunluğunu arttırdığı bilinmektedir ve bu reseptörün aktivasyonu, adenil siklaz aktivitesini bastırmak için benzer bir G-protein havuzuna bağlandıkları anlamında CB1 reseptörünün aktivasyonuna benzerdir; [126] çapraz tolerans mekanizması, iki sinyal yolağının reseptör-G-protein arayüzünün akış aşağısında mevcut olabilir. [126] [131]
Kafeine toleranslı farelerde, bilişsel testten önce kısa süreli olarak tek bir Δ9THC dozu verilmesi , sadece Δ9THC’ye göre, yalnızca kafein toleranslı farelerin, kafein toleransı olmayan farelere göre kötüleşmesine rağmen, kannabinoidden daha kötü uzaysal hafıza eksikliği gösterdiğine dikkat çekti. . [127]
Bunun olası bir açıklaması, CB1’in astrositlerin aktivasyonundan serbest bırakılan glutamata [639] ve bunun glutaminerjik sinyalizasyonunun aktivasyonuna ve NMDA ve AMPA reseptörlerinin aşağı düzenlenmesi ve içselleştirilmesi için bir COX-2’ye bağımlı mekanizmasıdır. [186] Azalan reseptör yoğunluğu, Marijuana (Esrar) kullanımından kaynaklanan hafıza zayıflıklarının altında yatabilir, çünkü glutamatın Marijuana ile uyarılan hafıza zayıflığının anahtar bir özelliği olan sinaptik plastisiteyi arttırma kabiliyetini zayıflatır.
CB1’in (astrositlerden ziyade) nöronlarda aktivasyonu normal olarak glutamat salınımını bastırır, [190] A1 reseptör yoğunluğunda bir artış, daha az nöronal bastırma ve hipokampal hücrelerde sinaptik glutamatta göreli bir artış ile ilişkilendirilir. [190 ] [184] A1 aktivasyonu, CB1 aracılı glutamat salınımının baskılanmasını zayıflatır. [127]
Hayvan verileri, kafeinin toleransının, Δ 9 THC’nin Kısa süreli uzamsal bellek oluşumu üzerindeki olumsuz etkisini artırabileceğini göstermektedir.
16.3 COX2 İnhibitörleri
NSAID ilaçları (indometasin, aspirin ve ibuprofen gibi), Marijuana (Esrar) maddesinin, CB1 reseptör aktivasyonu ile uyarılan COX2’yi bastırarak algılanan nörolojik etkilerinin bazılarını bastırabildiği düşünmektedir ve glutamat reseptörlerinin azaltarak düzenlemesine yol açar. [186][640] [641] Δ-9THC uygulamasıyla eşzamanlı olan bu COX2 bastırmasının Δ-9THC’den hafıza bozulmasını önlediği, Δ-9THC’nin β-amiloid pigmentlerini azaltma ve nörodejenerasyonu azaltma özelliğini koruduğu görülüyor. [186]
- β-amiloid : Alzheimer hastalarının beyinlerinde bulunan amiloid plakların ana bileşeni olarak Alzheimer hastalığında çok önemli rol oynayan 36-43 amino asitten oluşan peptidleri ifade eder.
16.4. Nikotin
Nikotin, sigaranın ana uyarıcı bileşenidir ve beyindeki sinyali, ana Kanabinoid reseptörü (CB1) ile etkileşime girmiş görünmektedir.
CB1 reseptörünün aktivasyonunun nikotin için takviye uyarımını güçlendirebileceği ve nikotinden çekilen farelerde nikotin arayan davranışa neden olabileceği düşünülmektedir. [642] Buna karşılık, CB1 reseptörünün eylemlerini bloke etmek, nikotin nükleer aralıklarına nikotinden dopamin salınımını azaltabilir ve nikotin kendine yönlendirme ve nikotin aramak için motivasyonu azaltabilir. [632]
CB1 etkidaşları, önceden uygulanmış CB1 etkidaşlarını, nikotin için motivasyonun azaltılmasında etkili olması gerekmez. [643] [644] Nikotin, kemirgenlerde çekilme etkileri gibi THC’ye Kısa süreli fizyolojik yanıtların bazılarını arttırdığı da gözükmektedir. [645]
Kannabinoid reseptörünün aktivasyonu, farelerde nikotinin bazı bağımlılık özelliklerini artırabilmektedir. Bunun tersine, kemirgen deneyleri, nikotinin, geri çekilme de dahil olmak üzere THC’nin bazı fizyolojik etkilerini güçlendirdiğini göstermiştir.
16.5 Yüksek Yağlı Diyet
Farelerde, Δ 9 THC’nin, dahili kanabinoidlerin (endokannabinoidler) anandamid ve 2-araşidonoilgliserol düzeylerinin yükselmesinden dolayı CB1 reseptörünün desensitizasyonundan kaynaklanacağını düşünen yüksek yağlı bir diyet kaydedilmiştir. [646]
17 Güvenlik ve Yan Etkileri
17.1 Tolerans
Vücut, Marijuana (Esrar) kullanımına ve Δ 9 THC’nin toleranslı hale gelebilir ve bu, Δ 9 THC’nin psikoaktif özelliklerine aracılık eden CB1 reseptörünün desensitizasyonuna atfedilebilir. [128][647] [648]
Reseptörün sinyallemesine aracılık eden CB1’in bağlandığı G proteinleri (Gi ve Go [95]), dokunun Δ9THC’ye kronik olarak maruz kalması nedeniyle duyarsızlaştırılmış bir reseptörde daha düşük bir dereceye kadar aktive edilir ve bu duyarsızlaştırma, sadece Δ9THC’den ziyade CB1 reseptörünün çoğu kannabinoid agonisti ile görülür.(ligandlar arasında farklılıklar olmasına rağmen)
G proteinlerinin daha düşük bir dereceye kadar aktive edilmesinin ana nedeni, daha güçlü agonistler tarafından daha hızlı içselleştirmeyle zamana ve doza bağlı bir şekilde meydana gelen yüzey CB1 reseptörlerinin kaybıdır ve reseptör konsantrasyonundaki bu düşüşün muhtemelen reseptör içselleştirmesinden kaynaklanmasıdır. (birçok G-protein eşli reseptör için agonist kaynaklı duyarsızlaştırmanın temelini oluşturur). [145] [665]
CB1 reseptörünün, Δ 9 THC de dahil olmak üzere herhangi bir etkidaşa maruz kalması, reseptörün sonunda hücre zarı dışına çıkmasına neden olabilir. Bu, alıcının Δ 9 THC’den daha az aktivasyona uğramasına, hücre içinde daha az sinyal vermesine ve ilaca toleransa neden olur.
CB1 reseptör mevcudiyetinde azalma, açısal tekil korteks, prefrontal korteks ve parietal, posterior singulat ve oksipital korteksler gibi diğerleri arasında açısal tekil korteks dahil olmak üzere birçok beyin bölgesinde belirtilmiştir. [666] CB1 reseptör aktivitesini normalleştirmek için marijaunadan yaklaşık dört hafta uzak durma yeterlidir. [666]
CB1 reseptörünün bulunabilirliğinde azalma, köşe singulate korteks , prefrontal korteks ve parafizokampal girus gibi parietal, posterior singulat ve oksipital korteks gibi birçok beyin bölgesinde not edilmiştir. [651] Genel olarak aşağı düzenlenmesi, kortikal bölgeleri subkortikal bölgelerden daha fazla etkiler; kortikal bölgelerde% 20’ye varan bir azalmaya ulaşırken, subkortikal bölgeler durduktan sonra daha kolay iyileşir (fare verilerine dayanarak [668]).
Kronik Marijuana (Esrar) kullananlarda CB1 reseptörünün bulunabilirliğinde azalma kaydedilmiştir. CB1’in kullanılabilirliğindeki bu azalma, dört haftalık yasaktan sonra normalize edilmiştir.
17.2 Bırakma
Esrardan geri çekilme vardır, ancak alkol, benzodiazepinler veya opioidlerden geri çekilme ile görülen herhangi bir önemli tıbbi veya psikiyatrik sorunla ilişkili olmadığı için diğer ilaçlardan farklı görünüyor; esrarın geri çekilmesi, tekrar riski olan refah için önemli fiziksel ve zihinsel bozulmaları da içerme eğilimindedir. [669]
Geri çekilme semptomlarının tekrar riskindeki rolü açısından, esrarın ciddiyetle tütünle karşılaştırılabilir olmasına rağmen, her ikisinden de aynı anda çekilmenin tek başına olduğundan daha şiddetli olduğu bildirilmiştir. [670] Çekilme belirtileri neredeyse anında görülür ve yaklaşık bir hafta ile bir ay içerisinde azalır. [672] [673] Nikotinin, tütün çekilmesini tedavi edebilmesine benzer şekilde, Δ9THC’nin oral desteği, esrarın çekilmesine bir miktar yarar sağlar gibi görünmektedir. [674] [675] [676]
Esrar çekilmesinin belirtileri arasında uyku, huzursuzluk, iştahsızlık, moral bozukluğu, sinirlilik veya endişe, sinirlilik ve fiziksel semptomlar / rahatsızlık vardır; Yukarıda bahsedilen yedi kişiden en az üçü, esrar yoksunluğu sendromu (DSM-V) tanısı için mevcut olacaktı. [677]
Fiziksel semptomlar, mide ağrısı, titreme, terleme, üşüme ve / veya baş ağrısı gibi semptomlara atıfta bulunur, ancak genellikle diğer semptomlardan daha az rapor edilmektedir. [678] Başlıca psikolojik yoksunluk belirtileri iştahın azalması, uyku zorluğu, sinirlilik ve öfke, garip rüyalar, huzursuzluk ve esrar istemeleridir. [679] Bu semptomların zaman süreci önemli ölçüde değişebilir. [680] [672]
Esrar çekilmesi yaklaşık bir hafta ile bir ay arasında sürer. Semptomlar hem fiziksel hem de zihinseldir, fiziksel semptomlar daha az yaygındır. Başlıca belirtiler arasında uykusuzluk ve uyuma, baş ağrıları, huzursuzluk, iştah değişikliği ve esrar arzusu vardır.
Bozulmuş uyku, sıkça bildirilen bir esrar çekilme belirtisidir ve bu bozulmanın yoğunluğu, esrarın kesilmesinin zamanla giderek azalmasından kısa bir süre sonra daha yüksektir. [685] [672] Kendini bildiren yan etkileri kullanan iki çalışma, semptom yoğunluğunda bir düşüşe işaret ederken, polisomnogram ile uyku kalitesini değerlendiren bir çalışmada, uyku kalitesinin esrarın bırakılmasının ilk 13 günü boyunca, subjektif olmasına rağmen, bozulma olduğuna dikkat çekerken, tam yoğunluğun seyri değişkendir.
Çalışmanın 45 günlük seyri boyunca garip rüyalar devam etse de, yetişkinlerde uyku bozukluğunun derecelendirmelerinin bir hafta içinde başlangıç seviyesine döndüğü görülmüştür. [672]
Esrar bırakma ile bozulmuş uyku kalitesi en sık bildirilen geri çekilme etkilerinden biridir ve ilk bırakma haftasında en fazla şiddetli görünmekle birlikte yoğunluğu düşmekte, ancak yine de bir aylığına kadar devam etmektedir ; garip rüyalar daha da uzun süre devam edebilir.
Sinirlilik, huzursuzluk ve öfke semptomları genellikle esrarın bırakılması ile bildirilir. Sinirlilik, aynı zamanda uyku bozukluğu ve fiziksel huzursuzluğun iki haftadan az bir sürede başlangıç çizgisine döndüğü zaman boyunca gözükse de, daha erken bir başlangıç ve diğer semptomlardan daha uzun süre devam edebilir. [672] Daha sonra başlamış olmasına rağmen, öfke de normalden daha uzun sürer. [672]
Sinirlilik, huzursuzluk ve öfke çoğu zaman esrarın geri çekilmesinde bir grup belirti olarak ortaya çıkar ve değişken başlangıç ve durma zamanları vardır.Hayvan modelleri, esrarın geri çekilmesinin motor semptomlarının bir kısmına yol açan mekanizma hakkında bir fikir vermişti.
IL-1 reseptörünün uyarılması, IL-1β enjeksiyonları ile değerlendirildiği gibi kas koordinasyon bozukluğunu uyarabilir. [688] [689] Altta yatan mekanizma, CB1 reseptörlerinin uyarılmasının glutaminerjik aktiviteyi nasıl azalttığına kadar geri izleneceği varsayılır; Bu reseptörlerin bir aşağı düzenlenmesi, iltihaplı toksisite ile sonuçlanan glutamat sinyalini şiddetlendirir.
IL-1 ‘in doğrudan Purkinje hücrelerini uyardığı bilinmektedir, ancak geri çekilme sırasında sıçanlarda açık bir nöronal hasar görülmemiştir, ancak bu hücrelere doğru sinir iletiminin geri çekilme sırasında değiştirildiğini göstermektedir. Purkinje nöron ateşlemesinde değişikliklere neden olan kısa ömürlü bir artmış iltihaplanma ve doku ölümü durumuna kadar izlenen sıçanlarda Marijuana çekilmesi sırasında motor kontrolünde bir azalma olduğu kaydedilmiştir.
17.3 Bağımlılık
Esrar bağımlılığı, DSM IV-TR testinde, aynı 12 aylık sürede herhangi bir zamanda ortaya çıkan aşağıdaki semptomlardan 3 veya daha fazlasına sahip olarak tanımlandı ; tolerans, esrarı amaçlanandan daha büyük miktarlarda veya daha uzun sürede almak, kullanımı azaltma isteğinde bulunmak veya arzulamak, ilacı elde etmek için çok fazla zaman harcamak veya kullanmak veya kullanmaktan kurtulma teşebbüsünde bulunmak, olumsuz sonuçlarının farkında olmasına rağmen kullanımına devam etmek ve kullanımdan dolayı önemli faaliyetlerden vazgeçmek vs.
Bu kriterlere göre, Amerikalıların yaklaşık yüzde 4.3’ü hayatlarının bir noktasında Marijuana (Esrar) maddesine bağımlı durumdadır. [677] Bununla birlikte, daha yeni bir sürüm olan DSM V, bu spesifik bağımlılık kategorisini ortadan kaldırdı ve onu, bir madde kullanım bozukluğu kategorisinin yanı sıra özel olarak tanınan bir esrar yoksunluk sendromu ile değiştirdi. [680]
Marijuana (Esrar) bağımlılığı bozukluğunun kullanıcılar arasındaki oluşum oranının% 9 olduğu tahmin edilmektedir ve karşılaştırma için ürüne bağımlı tütün kullanıcısı miktarından daha azdır (% 32). [678]
Marijuana (Esrar), tüm sinir dokusunu uyaran ilaçlara benzer alışkanlık yaratan özelliklere sahiptir, ancak bir bağımlılık bozukluğu kriterini karşılayan kullanıcıların miktarı diğer yaygın teneffüs ilacından (tütün) daha azdır ve bırakmaya daha kolay bağımlı olduğu söylenir.
Nörobiyolojik olarak, uyuşturucu bağımlılığında yaygın görülen olay, dopamin sinir iletimiyle sonuçlanan striatum olarak bilinen bir beyin bölgesinde dopamin reseptörünün bulunabilirliği, özellikle D2 / D3 altkümeleridir. Böyle bir olay alkole, amfetaminlere, [166] kokaine, [167] eroin, [679] ve opioidlere [680] bağımlı olarak kaydedilmiştir. Ancak bu Marijuana bağımlılığa rağmen, dopaminerjik sinyalizasyon için herhangi bir bozulma göstermekte başarısız olmuştur veya reseptörün bulunabilirliği ile ilgilidir. [168] [169] [170] [171]
Nörobiyolojik olarak, beynin bağımlılığının klasik bir belirtisi olan striatum ve lokal beyin bölgelerinde dopamin sinyallemesinde bir azalma, bu mekanizmayı paylaşan kötüye kullanımın diğer birçok yaygın uyuşturucuya karşın Marijuana (Esrar) için uzanmış gibi görünmemektedir.
17.4 Örnek Durum Çalışmaları
Marijuana (Esrar) çeşitli derecelerde ima edilen nedenselliğe dayalı vaka incelemelerinde sayısız yan etkiyle ilişkilendirilmiştir. Vaka çalışmaları arasında pankreatit, [496] [681] [ 683] büyümüş diş etleri, [684] mani, [681] bulantı ve kusma, [685] geçici iskemik ataklar, [686] [687] ve atriyal fibrilasyon yer alıyor. [688]
Esrar kullanımına bağlı kardiyovasküler geçmişi olmayan vakaları ile ilgili birkaç ölümcül olmayan ve ölümcül kalp krizi (koroner trombozdan kaynaklanan) ve diğer çeşitli koroner sendromlar, felç ve kombine serebral ve kalp krizi vakaları vardır. [695] Bazı durumlarda, en azından nedensel bir bağlantıya işaret eden Marijuana sindiriminde semptomlar ortaya çıkmıştır. [696] [697] [698] [698]
Esrar solunmasının, önceden bilinen semptomları veya komplikasyonları olmayan insanlarda da olumsuz etkiler görüldüğü halde, önceden var olan semptomları şiddetlendiren kısa süreli bir “tetikleyici” olarak hizmet edebileceği varsayılmıştır. [713]
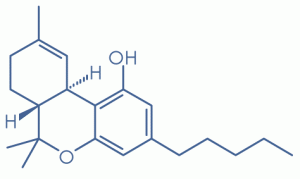
Bilimsel Destek ve Referans Metni
Marijuana (Esrar) Referanslar
- Pozitron emisyon tomografisi ile ölçülen bölgesel serebral kan akımındaki tetrahidrokanabinol kaynaklı değişikliklerin seyri .
- Kanabinoidlerin insanlarda serum kortizol ve prolaktin üzerindeki etkileri
- Mısır mumyalarında uyuşturucuların ilk tanımlanması .
- Erkek farelerin üreme sistemine kronik bhang (esrar) uygulamasının etkileri .
- Esrarın kimyası, metabolizması ve toksikolojisi: klinik çıkarımlar .
- Yüksek potensli Esrar sativalarından kannabinoid ester bileşenleri .
- Marijuana (Cannabis sativa L.) ‘nin lif ve ilaç türleri ile vahşi ve evcilleştirilmiş girişlerden oluşan bir toplama arasındaki fark .
- Dünya Uyuşturucu Raporu 2010 .
- HIV pozitif hastalarda tıbbi Marijuana : ne biliyoruz .
- Tıbbi esrarın yasal statüsü .
- Esrarın kimyasal bileşenleri: doğal kanabinoidlerin karmaşık karışımı .
- Yeni Kannabis bileşenlerinin yüksek potansiyel çeşitliliğinden izolasyonu ve karakterizasyonu .
- (+) – kannabitriol ve (-) – 10-etoksi-9-hidroksi-delta 6a {10a} -tetrahidrokanabinolün izolasyonu ve karakterizasyonu: Cannabis sativa L. özünden iki yeni kannabinoid .
- (+/-) 9,10-Dihidroksi-delta6a (10a) -tetrahidrokanabinol ve (+/-) 8,9-dihidroksi-delta6a (10a) -tetrahidrokanabinol: Cannabis sativa L’den 2 yeni kannabinoid .
- Cannabis sativa L’den (haşhaş) ekstrakte edilen bazı maddelerin psikofarmakolojik aktiviteleri .
- Cannabinerolic acid, Cannabis sativa’dan bir kanabinoid .
- Hollanda kahve dükkanlarında satılan esrar preparatlarında toplam delta-THC’de güçlü artış .
- 1993’ten 2008’e kadar el konan esrar preparatlarında Δ9-THC ve diğer kanabinoidlerin potens eğilimleri .
- 1980-1997 yıllarında el konan esrarda delta9-THC ve diğer kannabinoidlerin potens eğilimleri .
- Esrar sativa esansiyel yağı .
- Cannabis sativa’nın taze ve hava ile kurutulmuş tomurcuklarının uçucu yağ bileşimi
- Beta-karyofillen bir diyet kannabinoiddir .
- Yüksek potensli Cannabis sativa çeşitlerinden kannabinoid olmayan bileşenler .
- Pediatrik onkolojide etkili yeni bir kanabinoid antiemetik .
- Sporda esrar: anti-doping perspektifi .
- Esrar için pozitif ilaç testleri için pratik zorluklar .
- Aktif ve gerçekçi pasif esrar maruziyeti idrarda üç immunoassay ve GC / MS ile test edilmiştir .
- Esrar dumanının pasif inhalasyonu: delta-9-tetrahidrokanabinolün idrar tahlili ve oda hava seviyeleri .
- Marijuana dumanının pasif inhalasyonu ve kannabinoidlerin idrar atılımı .
- Esrar dumanının pasif inhalasyonu .
- Pasif inhalasyon ve oral sindirimden sonra esrar etkileri ve idrar tahlili .
- Esrar dumanına pasif maruziyet sonrası yüksek ve idrar kannabinoid atılımı başvurun .
- Tetrahidrokanabinolün transdermal verilmesi .
- Oldukça lipofilik bir molekülün deriye nüfuz etmesinin değişmesi: tetrahidrokanabinol
- Delta8-tetrahidrokanabinol, Kannabinol ve kannabinolün insan cildinin nüfuz etmesi .
- Tetrahidrokanabinol deri nüfuziyetini ölçmek için in vitro deney optimizasyonu .
- Transdermal delta 8-THC gelişimi için in vitro / in vivo korelasyon çalışmaları .
- Kantitatif otoradyografi ile in vivo sıçan derisine nüfuz eden lipofilik moleküllerin lokalizasyonu .
- Kannabinoidlerin farmakokinetiği ve farmakodinamiği .
- Ağır ve hafif kannabis kullananlarda delta 9-tetrahidrokanabinolün (delta 9-THC) klinik etkileri ve plazma seviyeleri .
- Ağır ve hafif esrar kullanıcılarında döteryum etiketli delta 1-tetrahidrokanabinol etiketli tek doz kinetiği .
- Stabilite, esrarın (esrar) kannabinoid bileşenlerinin sigara içimi sırasında aktarılması ve emilmesi .
- Kadınlarda ve erkeklerde delta-9-tetrahidrokanabinolün metabolizması, eldesi ve kinetiği .
- Kannabis reçinesinin ağızdan alınmasını takiben kanabinoidlerin metabolizmasının ve vücuttan atılmasının adli yanları .
- Delta 9-tetrahidrokanabinolün plazma konsantrasyonları zehirlenme derecesini yansıtır
- Garrett ER, Hunt CA Δ9-tetrahidrokanabinolün fizikokimyasal özellikleri, çözünürlüğü ve protein bağlanması .
- Oral ve intravenöz uygulama ve sigara kullanımından sonra plazma delta-9 tetrahidrokanabinol konsantrasyonları ve klinik etkileri .
- Tek veya çok sayıda intravenöz dozu takiben tavşanlarda delta 9-tetrahidrokanabinolün farmakokinetiği .
- İnsandaki (+) – ve (-) – Δ1-tetrahidrokanabinollerin ve (-) – 7-hidroksi-1-tetrahidrokanabinolün kan hücrelerine ve plazma proteinlerine bağlanması .
- Delta-1-tetrahidrokanabinolün insan plazma proteinlerine bağlanması .
- İntravenöz enjeksiyon ve sigaradan sonra sıçan plazmasındaki 14C-delta1-THC’nin kaderi .
- Teneffüs edilmiş-1 delta 9Tetrahidrokanabinolün inhalasyondan sonra sıçan dokularında dağılımı .
- İnsan beynindeki biyokimyalardaki delta 1-tetrahidrokanabinolün gaz kromatografisi-kütle spektrometresi ile belirlenmesi .
- Delta-9-Tetrahidrokannabinol : Vücut Yağında Lokalizasyon .
- Sıçanlarda akut veya çoklu prenatal dozajı takiben barajlar ve fetüslerde delta-9-tetrahidrokanabinolün plazma konsantrasyonları
- Gebe köpeklerde ve fetuslarda 3H-delta9-tetrahidrokanabinol dağılımı .
- Bir esrar sigara dumanı teneffüs ettikten sonra hamile koyun ve fetusda plazma delta-9-tetrahidrokanabinol .
- İnsan sütünde delta9-tetrahidrokanabinol varlığı .
- Delta 9-tetrahidrokanabinolün, maymunların hepatik mikrozomlarından saflaştırılan sitokrom P450 izozimleri ile metabolizması .
- Yetişkin dişi sıçanların karaciğer mikrozomları ile delta 9-tetrahidrokanabinolün oksidatif metabolizmasında rol alan sitokrom P-450 izozimleri .
- CYP2C’nin yaşlı bir kadından alınan insan hepatik mikrozomları ile kanabinoid metabolizmasında yer alması .
- Kannabinoidlerin karşılaştırmalı in vitro metabolizması .
- Tetididrokanabinolün rhesus maymun karaciğeri ve insan karaciğeri tarafından in vitro metabolizması .
- Tolerans ve insanda tetrahidrokanabinol yerleşimi .
- Delta 9-tetrahidrokanabinol-11-oic asit glukuronidin insan idrarında tanımlanması: bir tetrahidrokanabinol metaboliti .
- Farklı uygulama yöntemlerinden sonra farelerde kanabinoidlerin metabolizması ve dağılımı .
- Kan kanabinoidleri. I. THC emilimi ve sigara içimi sırasında ve sonrasında 11-OH-THC ve THCCOOH oluşumu .
- Delta-9-tetrahidrokanabinol: uzun süreli Marijuana sigara içenlerde metabolizma ve eğilim .
- Δ9-tetrahidrokanabinolün fizikokimyasal özellikleri, çözünürlüğü ve protein bağlanması .
- Bir grup kronik kullanıcıda son kullanımdan sonra kannabinoid metabolitlerin atılım paternleri .
- Biyolojik matrikslerin (idrar, kan, saç) yeni veya devam eden esrar kullanımının bir göstergesi olarak incelenmesi .
- Delta9-tetrahidrokannabinolik asit A için saç analizi – kannabinoidlerin saça eklenmesi mekanizmasının yeni içgörüsü .
- Tütün ve Marijuana sigara bırakma, klozapin veya olanzapin ile zehirlenmeye yol açabilir .
- Tütün sigara bırakma işleminin stabil klozapin veya olanzapin tedavisi üzerine etkisi .
- İnsan CYP1 enzimlerinin izoform seçici ve güçlü inhibitörleri olarak majör fitokanabinoidler, Kannabinol ve kannabinolün karakterizasyonu .
- Kannabinol , sitokrom P450 2C19’un katalitik aktivitesinin güçlü bir inhibitörüdür .
- Esrar dumanında bulunan majör fitokanabinoidlerin ve polisiklik aromatik hidrokarbonların sitokrom P450 2C9 aktivitesi üzerindeki in vitro inhibitör etkilerinin karşılaştırılması .
- CYP2D6 için güçlü bir atipik inhibitör olarak büyük bir fitokanabinoid olan Kannabinol .
- İnsan sitokromu P450 2A6 ve 2B6’nın majör fitokannabinoidler tarafından diferansiyel inhibisyonu .
- Fare hepatik sitokrom P450’nin Kannabinol ile indüksiyonu ve genetik düzenlemesi .
- Sitochrome P450 enzimleri, insan hepatik mikrozomları ile tetrahidrokanabinol ve kannabinol metabolizmasında rol oynar .
- İnsan sitokrom P450 3A izoformlarının Kannabinol ile güçlü inhibisyonu: resorsinol parçasında fenolik hidroksil gruplarının rolü .
- Fare karaciğer sitokrom P-450IIIA’nın Kannabinol tarafından seçici inaktivasyonu .
- Kannabinol aracılı sitokrom P450 inaktivasyonunun karakterizasyonu .
- İrinotekanın klinik farmakokinetiği ve metabolizması (CPT-11) .
- İnsan sitokromu P450 3A4 ve 3A5’in, taksoter metabolizmasında ve türevlerinde rolü: enzim spesifitesi, insani bireyler arası dağılımı ve insan karaciğerindeki metabolik katkısı .
- Tıbbi Marijuana , irinotekan ve dosetakselin klinik farmakokinetiğini etkilemez .
- Viagra ve esrarın ortak rekreasyon kullanımından sonra miyokard enfarktüsü .
- Kannabinoidlerin indinavir ve nelfinavir’in farmakokinetiği üzerine etkileri .
- Uluslararası Farmakoloji Birliği. XXVII. Kanabinoid reseptörlerinin sınıflandırılması .
- Endokrinabinoid sistemin endokrin regülasyonunda ve enerji dengesindeki ortaya çıkan rolü .
- İnsan neokorteksinde uyarılmış dopamin salımının ve adenil siklaz aktivitesinin kannabinoid CB1 reseptör aracılı modülasyonu
- CB (1) kanabinoid reseptörleri ve ilişkili proteinleri .
- WIN55,212-2 ve delta (9) -THC ile sinaptosomal Na +, K + -ATPaz aktivitesinin modülasyonunda kannabinoid CB1 reseptörlerinin ve Gi / o protein aktivasyonunun rolü .
- G protein sinyallemesinin 3 aktivatörü, protein kinazın opiat aktivasyonunu düzenler. Eroin arayışı davranışının bir sinyallemesi ve nüksetmesi .
- Kannabinoid CB1 ve dopamin D2 reseptörlerinin eşzamanlı uyarımı striatal nöronlarda cAMP birikmesini arttırır: CB1 reseptörüne bir Gs bağlantısı için kanıt
- Kannabinoid agonisti WIN55,212-2, CB1 reseptör bağlanması yoluyla hücre içi kalsiyumu Gq / 11 G proteinlerine arttırır .
- İnsan trabeküler ağ örgüsü hücrelerinde agonist bağımlı kannabinoid reseptör sinyalizasyonu .
- CB2 kannabinoid reseptör aktivasyonu, dahili opioidlerin periferal salınımını uyararak antinosisepsiyon meydana getirir .




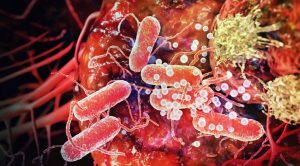








Bu kadar emek edip bunu yazan kişiyi gerçekten tanımak isterim , eğer sizde başka bi yerden almadıysanız :). Seminerim için araştırma yapıyorum izniniz olursa buradan alıp buraya kaynakça da ithaf etmek isterim 🙂
Merhabalar,
İlginiz için teşekkür ederiz.Referans göstermeniz halinde sitemizdeki konuları çalışmalarınızda kullanabilir ve kaynakça gösterebilirsiniz.
Merhabalar bir sorum olucaktı vucut geliştirme sporu yapıyorum haftada 1 kez kullanıyorum bu maddeyi hormonlara bir zararı var mıdır merak ediyorum araştırdım fakat bulamadım